自《藥品注冊管理辦法》于2020年7月1日起正式施行����,其中增設了藥品加快上市注冊一章,設立突破性治療藥物程序�、附條件批準程序、優(yōu)先審評審批程序���、特別審批程序四個加快通道�,越來越多的新藥被納入突破性治療品種名單����。根據(jù)國家藥監(jiān)局發(fā)布的《2021年度藥品審評報告》���,2021年共有53件(41個品種)納入突破性治療藥物程序,覆蓋了新型冠狀病毒感染引起的疾病��、非小細胞肺癌��、卵巢癌等適應證�。2021年建議批準的NDA中,有5件被納入了突破性治療藥物程序得以加快上市����。
回顧2022年,據(jù)GBI SOURCE全球藥品數(shù)據(jù)庫����,截至12月21日,共有39種藥物獲得CDE突破性療法認定����,其中21個為生物制品,18個為化學藥品(見下表)����。
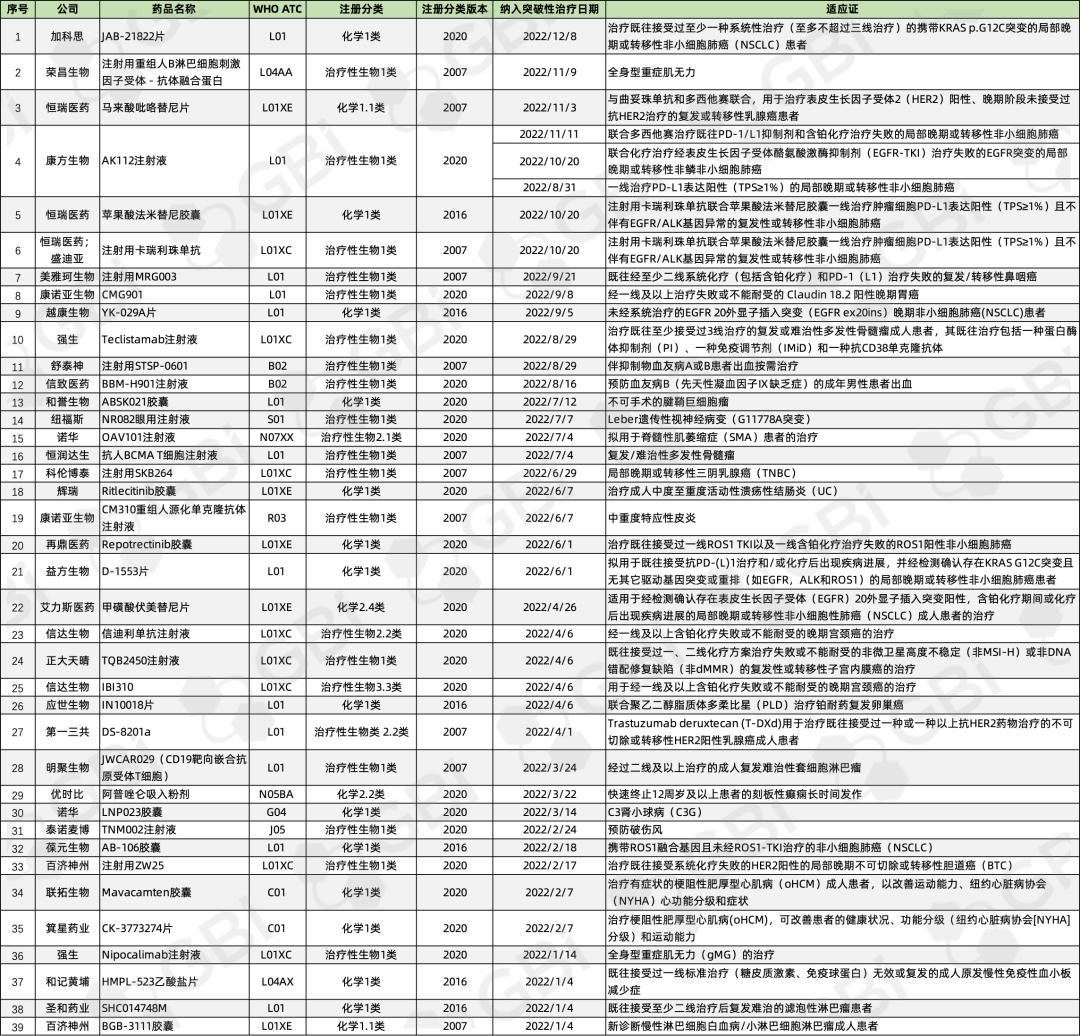
治療領域方面�����,以抗腫瘤藥物居多(25款)���,適應證涵蓋肺癌��、乳腺癌�����、淋巴瘤�、宮頸癌、骨髓瘤��、鼻咽癌����、胃癌等,其中與非小細胞肺癌有關的藥物多達9個���。其他藥物主要涉及血液����、泌尿、眼科����、心血管等領域。
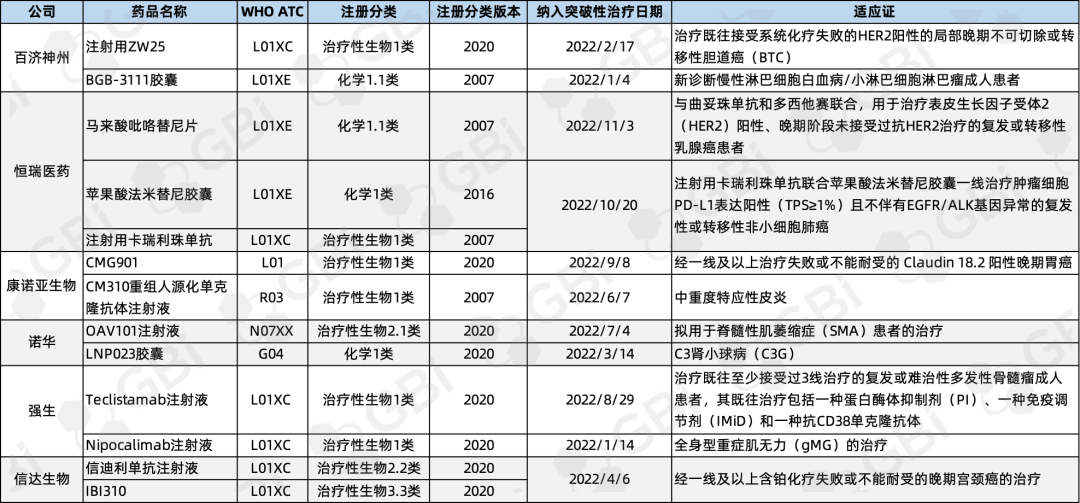
企業(yè)方面��,百濟神州�、恒瑞醫(yī)藥、康諾亞生物�����、諾華����、強生和信達生物均有超過1款藥物被納入突破性治療品種名單。
(來源:醫(yī)前沿)