三年來�����,新冠疫情對各行各業(yè)造成沖擊��,也成為影響醫(yī)藥行業(yè)的重要因子����。美國FDA一方面審批新藥上市,另一方面又進行藥品生產(chǎn)的監(jiān)管檢查����,三年間亦有起伏跌宕。本文梳理一些變化�����,以供借鑒。
1.新藥審批:節(jié)奏放緩
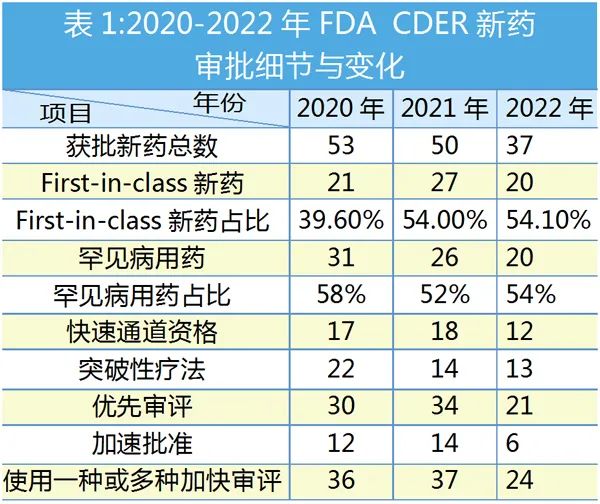
2020-2022年����,F(xiàn)DA批準新藥數(shù)量逐年減少,但“First-in-class”療法遞升���,在此不對獲批新藥一一列舉��,僅簡要分析逐年重要獲批看點���。
2020年:獲批數(shù)量可觀罕見病療法近六成
2020年FDA CDER面臨前所未有的挑戰(zhàn),但CDER共批準了53個新藥��,是20年來僅次于2018年的59款的第二高位����。
53個新藥中,有31個(58%)獲批用于治療影響20萬或更少美國人的罕見或“孤兒”疾病��,是這三年中數(shù)量與占比最高的一年���。
在美國���,罕見疾病患者通常很少或根本沒有可治療疾病的藥物���。當年獲批罕見病新藥應用范圍囊括狼瘡型腎炎、活躍性still病�����、遺傳性血性水腫���、庫欣病、嗜酸性細胞增多癥等�;包括多發(fā)性骨髓瘤、神經(jīng)母細胞瘤����、慢性粒單核細胞白血病、骨髓增生異常綜合征����、胃腸道間質瘤、上皮樣肉瘤和轉移性膽管癌等罕見癌癥��;還有早年衰老癥候群和早衰樣核纖蛋白病等其他罕見病��。
其中����,Evrysdi(risdiplam)用于治療2個月及以上脊髓性肌萎縮癥(SMA)患者���,是一種罕見且通常致命的遺傳性疾病,影響肌肉力量和運動����。也是FDA批準的第三種SMA治療方法,但是唯一獲批的口服SMA治療方法�����;Lampit(尼非莫司)片劑獲得加速批準��,成為首個用于治療恰加斯病年齡小于2歲(從出生到18歲以下��,體重至少2.5公斤)兒科患者的療法����;Orladeyo(berotralstat)用于治療遺傳性血管性水腫患者,這是一種反復發(fā)作的嚴重腫脹(血管性水腫)��,最常見于四肢�����、面部、腸道和呼吸道的罕見疾病��。
值得一提的是���,這一年CDER批準了美國首個用于治療COVID-19(住院成人和青少年)患者的藥物���。
2021年:推出可互換生物類似藥癌癥領域出爆款
2021年���,F(xiàn)DA CDER共批準了50個新藥���。這一年,CDER采取了重要措施來推進糖尿病患者的治療選擇�����,批準了多個糖尿病藥物���。Semglee(甘精胰島素-yfgn)注射劑和Rezvoglar(甘精胰島素-aglr)注射劑分別被批準為Lantus(甘精胰島素)的可互換生物類似藥和生物類似藥����。
值得注意的是���,Semglee是2021年CDER批準的頭兩個可互換生物類似藥中的一個���,另一個是Humira的可互換生物類似藥Cyltezo�����。它們可以在藥房替換參照品�����,而不受州法律的約束�����,類似于仿制藥替換品牌藥的方式�����。
2021年也是炎癥性腸?。↖BD)或涉及消化道炎癥疾病治療藥的重要一年�。FDA批準了一個針對中度至重度活動性潰瘍性結腸炎成人患者的治療藥,這是IBD的一種��,結腸內(nèi)壁發(fā)炎并形成微小的開放性潰瘍��。2021年FDA繼續(xù)推進治療和預防HIV-1感染,批準多個HIV-1感染用藥����。
在神經(jīng)和精神疾病方面,F(xiàn)DA批準了兩個治療藥在緊急情況下逆轉阿片類藥物過量�。使用加速批準途徑批準了一個新藥來治療阿爾茨海默病,即備受爭議的Aduhelm。
2021年是美國國家癌癥法案實施50周年�����,該法案是致力于抗擊癌癥的具有里程碑意義的立法���。在這個紀念年,CDER批準了多種針對不同癌癥的治療��,包括4個用于非小細胞肺癌的新藥和首個獲批用于食道(食道相關)癌�����、胃癌和胃食管交界處(GEJ)腺癌一線治療的免疫療法��、1個用于早期三陰性乳腺癌����,或對針對HER2蛋白受體的激素療法或藥物治療無反應的癌癥的治療藥等���。
2022年:獲批數(shù)量較少創(chuàng)新藥物占比最高
過去10年里,CDER平均每年批準43款新藥�,但2022年CDER批準的37款新藥低于平均數(shù),一度引發(fā)市場擔憂�����。不過�����,20款“First-in-class”療法占全年獲批新藥總數(shù)的54.1%�,是三年來的最高值。
2.現(xiàn)場檢查:頻次增多
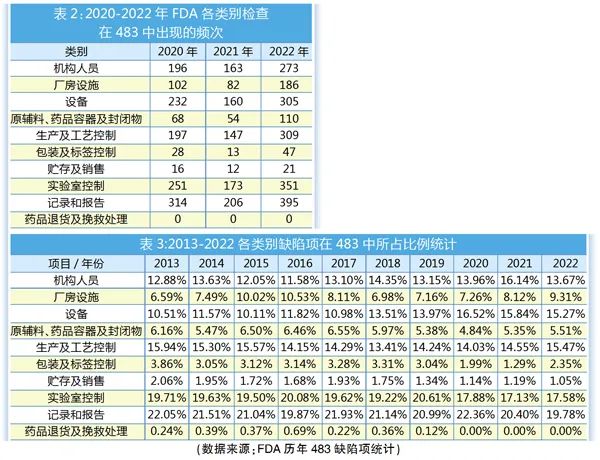
FDA483報告(缺陷報告)���,也稱現(xiàn)場觀察報告(Inspectional Observation)�����, 是FDA檢查官根據(jù)cGMP規(guī)范�����,對醫(yī)藥企業(yè)的質量體系進行現(xiàn)場檢查過程中所發(fā)現(xiàn)的不符合cGMP之處列出的總結清單����。2020-2022年,F(xiàn)DA各類別檢查在483中出現(xiàn)的頻次如表2所示���。
由于新冠疫情�����,導致FDA近3年來檢查數(shù)量明顯減少�,因此將時間線拉長���,匯總2013-2022年FDA 483年度審計缺陷列表�,并將分析基于各類別缺陷項在所有缺陷項中所占的比例�,以剔除檢查數(shù)量的影響��,客觀反應各類別缺陷項在歷年中的比例變化�,從而直觀反映FDA近年來檢查關注點的變化。
設備類缺陷項所占比例近年來有明顯升高趨勢�����,相比之下,包裝及標簽控制�、貯存及銷售、藥品退貨及挽救處理類有降低趨勢��。
(來源:醫(yī)藥經(jīng)濟報)