為貫徹落實《中華人民共和國藥品管理法》和《中華人民共和國疫苗管理法》�,2021年,國家藥監(jiān)局根據(jù)《藥品質(zhì)量抽查檢驗管理辦法》等有關(guān)要求����,以習(xí)近平總書記“四個最嚴”為根本指南,堅持問題導(dǎo)向和風(fēng)險控制原則����,組織各省級藥品管理部門與相關(guān)檢驗機構(gòu),在全國范圍內(nèi)對部分生產(chǎn)���、經(jīng)營��、使用��、進口等環(huán)節(jié)的藥品質(zhì)量開展抽查檢驗工作����,評估上市后藥品的質(zhì)量狀況,打擊制售假劣藥品行為�����。通過加強頂層制度體系構(gòu)建�����,整合抽檢資源���、以信息化引領(lǐng)監(jiān)管現(xiàn)代化�����,不斷促進抽檢成果運用向縱深推進,積極提升服務(wù)藥品監(jiān)管效能��。2021年國家藥品抽檢結(jié)果顯示�����,當(dāng)前我國藥品安全形勢總體平穩(wěn)可控,藥品質(zhì)量持續(xù)保持在較高水平��。
一�����、概述
藥品抽檢作為藥品上市后監(jiān)管的重要手段之一�,是實現(xiàn)風(fēng)險管理、科學(xué)監(jiān)管的重要技術(shù)支撐����。多年來,在打擊違法違規(guī)行為����、震懾不法企業(yè)、評價藥品質(zhì)量狀況��、提升行業(yè)標準�、警示公眾用藥安全、服務(wù)智慧監(jiān)管等方面發(fā)揮著重要作用���。
國家藥品抽檢作為一個全國上下聯(lián)動的協(xié)作項目�����,由國家藥品監(jiān)督管理部門統(tǒng)籌組織��,采取“分散抽樣���、集中檢驗����、探索研究��、綜合評價”的工作模式��。2021年�,國家藥監(jiān)局進一步優(yōu)化品種遴選機制,聚焦群眾關(guān)切���,重點遴選臨床使用量大���、日常監(jiān)管發(fā)現(xiàn)問題多的品種,同時配合基本藥物��、集中采購、進口檢驗等國家重大醫(yī)藥政策制定抽檢計劃及實施方案����。在抽樣環(huán)節(jié)采取分級抽樣模式��,由各省級藥品監(jiān)管部門組成的組織管理和監(jiān)管保障體系�,由全國31
個省(自治區(qū)�、直轄市)和新疆生產(chǎn)建設(shè)兵團負責(zé)抽取樣品;在檢驗研究環(huán)節(jié)遵循依標準檢驗和探索性研究并重的模式����,由中國食品藥品檢定研究院等47個承檢機構(gòu)組成的技術(shù)支撐體系,對抽檢樣品進行深度“體檢”�,并緊盯突出問題,結(jié)合監(jiān)管需求開展有針對性的探索性研究�����,不斷提升探索性研究與風(fēng)險挖掘的準確性��,建立以問題為導(dǎo)向的質(zhì)量分析研究體系�,揭示可能存在的質(zhì)量安全隱患,提升抽檢服務(wù)監(jiān)管的效能�����;同時完善風(fēng)險分級防控機制,對發(fā)現(xiàn)的問題隨時報告�����、隨時研判�����、隨時處置����。目前已逐漸構(gòu)建了基于全國藥品抽檢信息平臺的智慧化信息管理系統(tǒng),實現(xiàn)全過程實時動態(tài)管理�����,保障整個國家藥品抽檢政策的執(zhí)行流程清晰明確�。
2021年國家藥品抽檢共完成139個品種17856批次制劑產(chǎn)品與中藥飲片的抽檢任務(wù),樣品來源涉及3684家藥品生產(chǎn)���、經(jīng)營企業(yè)和使用單位�,覆蓋境內(nèi)31個省區(qū)市和新疆生產(chǎn)建設(shè)兵團�����,由47個藥品檢驗機構(gòu)承擔(dān)檢驗和探索性研究任務(wù)。對檢出的70批次不符合規(guī)定產(chǎn)品�,國家藥監(jiān)局組織各省級藥品監(jiān)管部門采取相應(yīng)的風(fēng)險控制措施。
針對探索性研究發(fā)現(xiàn)的問題線索��,國家藥監(jiān)局在風(fēng)險分析研判的基礎(chǔ)上����,實施以“檢監(jiān)結(jié)合”為重點的分級監(jiān)管�����。對可能存在安全隱患的產(chǎn)品����,及時部署采取相應(yīng)的風(fēng)險控制措施;對個別涉嫌存在違法違規(guī)問題的企業(yè)����,組織監(jiān)管部門開展現(xiàn)場檢查;對一般性問題���,采取風(fēng)險提示等措施督促相關(guān)企業(yè)排查整改��。
二���、抽檢數(shù)據(jù)分析
(一)抽樣情況
2021年國家藥品抽檢共抽取制劑產(chǎn)品與中藥飲片品種139個�,包括化學(xué)藥品81個��、中成藥46個����、中藥飲片9個、生物制品3個�,其中國家基本藥物品種53個;共抽檢樣品17856批次�����,包括生產(chǎn)環(huán)節(jié)3965批次��、經(jīng)營環(huán)節(jié)12409批次��、使用環(huán)節(jié)1250批次和口岸環(huán)節(jié)232批次(見圖1)�����,涉及1113家藥品生產(chǎn)企業(yè)����、2085家藥品經(jīng)營企業(yè)和486家藥品使用單位�,各?����。▍^(qū)�����、市)樣品抽取情況以及所抽取樣品的標示生產(chǎn)企業(yè)所在地區(qū)抽樣分布情況���,分別見圖2與圖3。
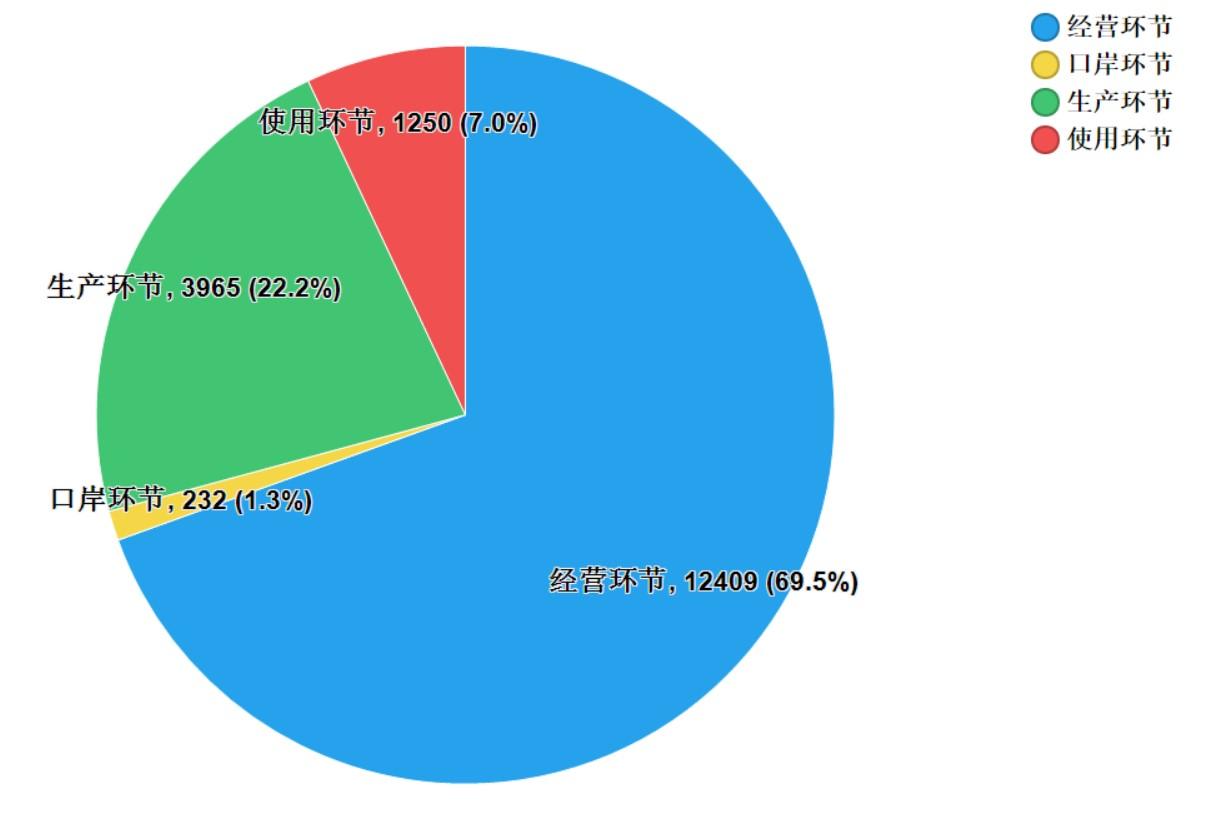
圖1.各抽樣環(huán)節(jié)抽樣情況
圖2.抽檢樣品來源分布圖

圖3.抽檢樣品產(chǎn)地分布圖
(二)藥品制劑抽檢數(shù)據(jù)分析
2021年國家藥品抽檢共抽檢制劑產(chǎn)品15899批次����。經(jīng)檢驗,15861批次產(chǎn)品符合規(guī)定��,38批次產(chǎn)品不符合規(guī)定�����。抽檢的130個品種中���,全部樣品符合規(guī)定的制劑產(chǎn)品有108個���,共12419批次�。其中���,化學(xué)藥品有70個品種7674批次����,中成藥有35個品種4681批次��,生物制品有3個品種64批次��。
1. 化學(xué)藥品
2021年國家藥品抽檢共抽檢化學(xué)藥品81個品種9455批次���,涉及生產(chǎn)環(huán)節(jié)1769批次��、經(jīng)營環(huán)節(jié)6577批次�����、使用環(huán)節(jié)877批次�����、口岸環(huán)節(jié)232批次����。經(jīng)檢驗,不符合規(guī)定18批次��,在生產(chǎn)�、經(jīng)營、使用���、口岸環(huán)節(jié)分別檢出不符合規(guī)定產(chǎn)品2批次����、16批次�����、0批次和0批次���,分別占對應(yīng)環(huán)節(jié)全部樣品的0.1%、0.2%�����、0.0%、0.0%(見圖4)����。
2021年國家藥品抽檢共涉及16個劑型,共有5個劑型存在不符合規(guī)定產(chǎn)品���。其中��,片劑(7批次)�����、膠囊劑(6批次)�、乳膏劑(3批次)�����、眼用制劑(1批次)�����、口服溶液劑(1批次)����,分別占對應(yīng)劑型全部樣品批次的0.2%��、0.6%����、1.4%�、0.5%、0.6%(見圖5)��。
不符合規(guī)定項目包括性狀�、鑒別、檢查和含量測定����,不符合規(guī)定產(chǎn)品數(shù)量依次為1、4��、14和2批次���,分別占全部不符合規(guī)定項目的4.8%、19.0%����、66.7%和9.5%(見圖6)。
抽檢數(shù)據(jù)顯示��,經(jīng)營環(huán)節(jié)出現(xiàn)不符合規(guī)定情況高于生產(chǎn)環(huán)節(jié),不符合規(guī)定項目中檢查項占比最大��,涉及“有關(guān)物質(zhì)”��、“溶出度”等檢驗項目���,不符合規(guī)定原因主要與生產(chǎn)工藝中壓片強度�����、原輔料混合程度�、運輸儲存過程中的溫度影響等相關(guān)因素有關(guān)��。
抽檢結(jié)果提示�,生產(chǎn)企業(yè)應(yīng)嚴格原料入廠檢驗,提高生產(chǎn)工藝穩(wěn)定性��、優(yōu)化關(guān)鍵質(zhì)量參數(shù)控制�����,重點關(guān)注乳膏劑����、口服溶液劑等劑型品種��,對檢查項目及檢驗指標反映的問題予以深入研究�;經(jīng)營企業(yè)應(yīng)加強藥品儲存���、運輸過程管理�����,完善溫濕度監(jiān)控體系�����,重點關(guān)注需要陰涼�、冷藏儲存等特殊條件保存的藥品����;建議監(jiān)管部門嚴格審查企業(yè)批生產(chǎn)記錄,核查原輔料投料量����,推動質(zhì)量標準提升��。
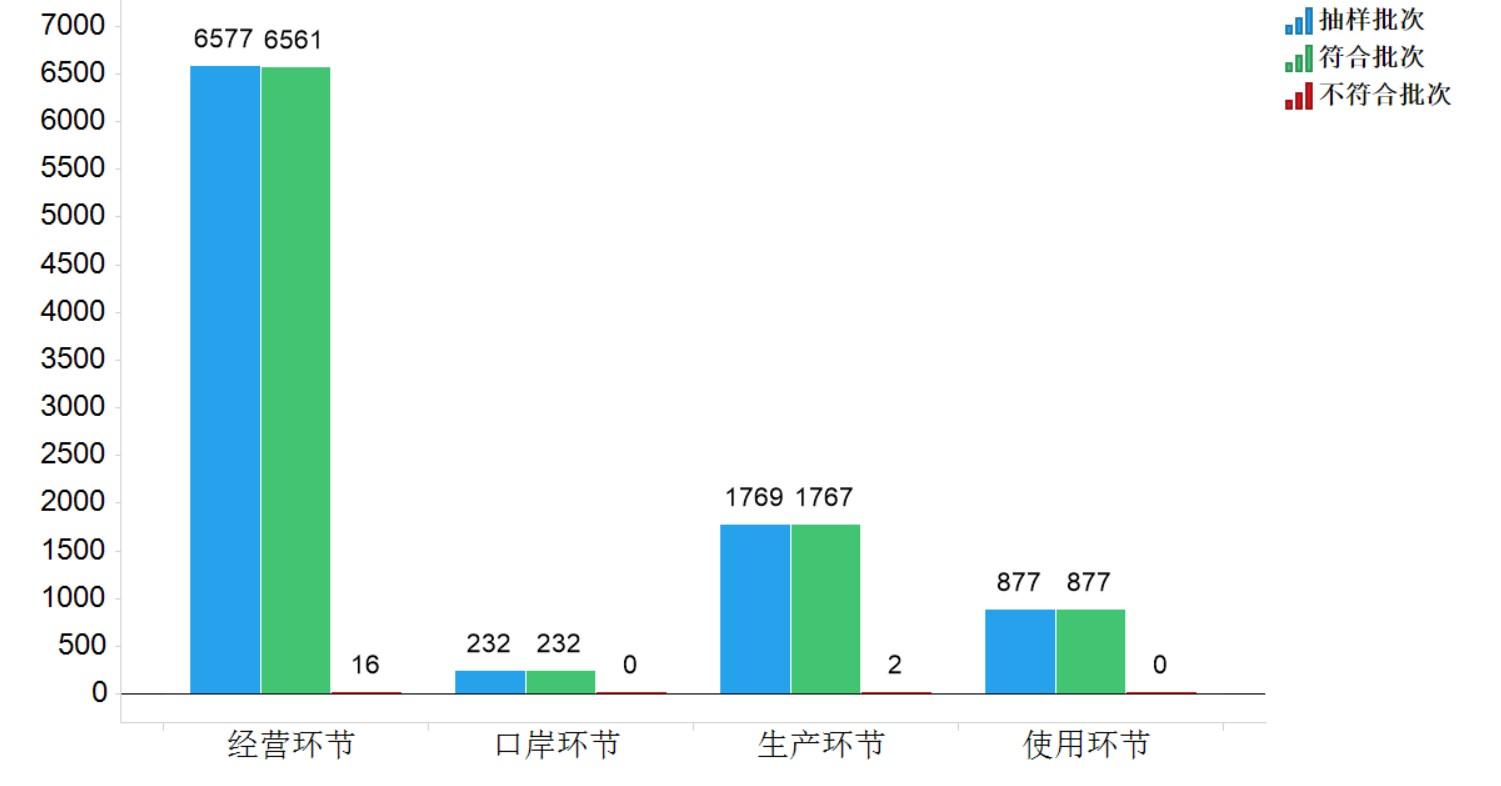
圖4.化學(xué)藥品各抽樣環(huán)節(jié)檢驗信息示意圖
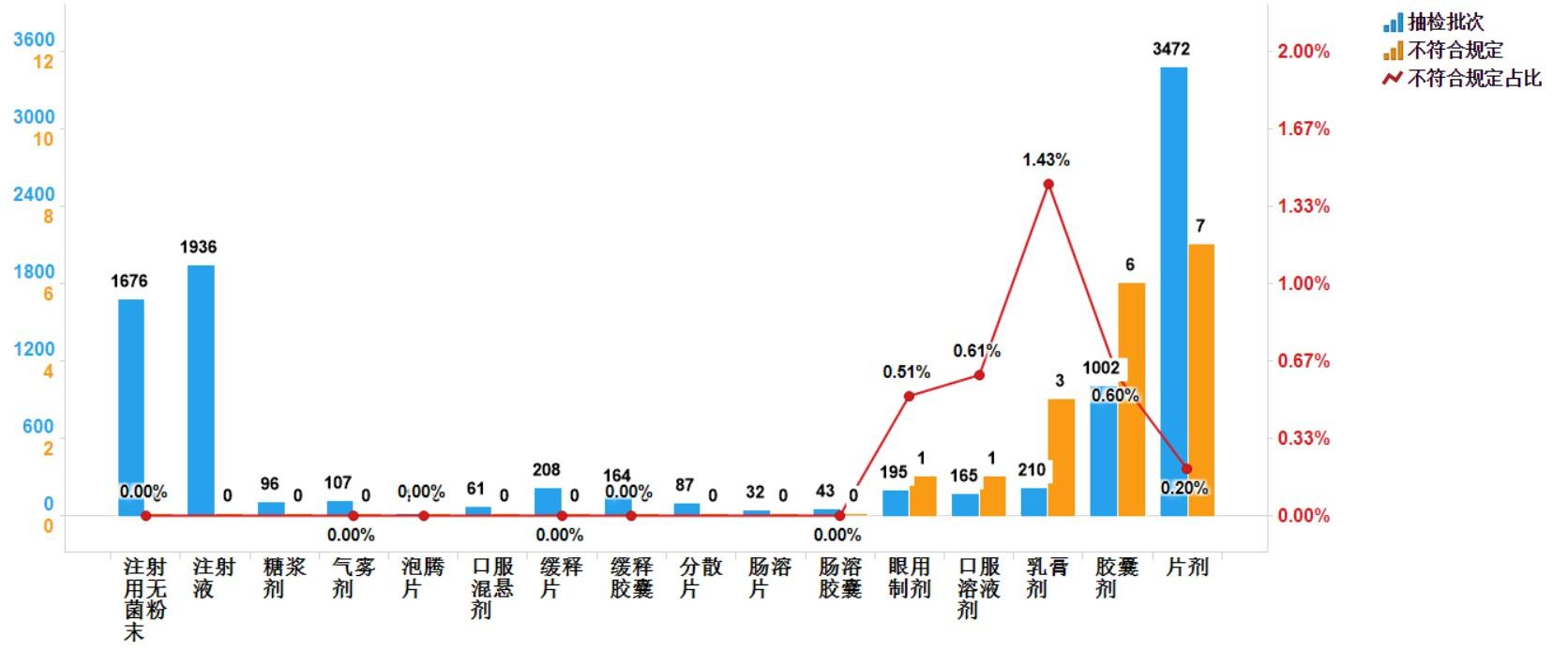
圖5.化學(xué)藥品各劑型檢驗信息示意圖
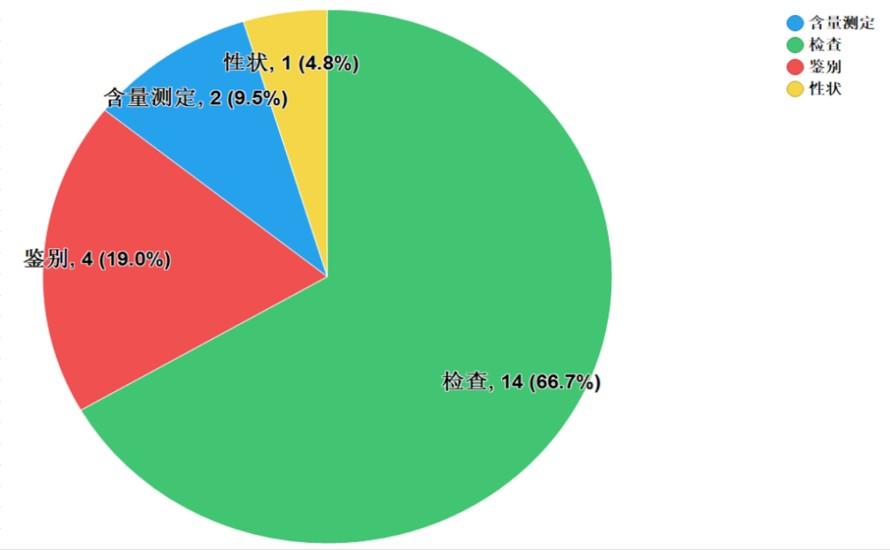
圖6.化學(xué)藥品不符合規(guī)定項目分布圖
注:某些不符合規(guī)定產(chǎn)品涉及多個不符合規(guī)定項目。
2. 中成藥
2021年國家藥品抽檢共抽檢中成藥46個品種6380批次����,涉及9個劑型,在生產(chǎn)����、經(jīng)營和使用環(huán)節(jié)各抽取樣品1417批次、4914批次��、49批次����。經(jīng)檢驗,符合規(guī)定6360批次��,不符合規(guī)定20批次���,分別在生產(chǎn)與經(jīng)營環(huán)節(jié)檢出不符合規(guī)定產(chǎn)品2批次和18批次��,分別占對應(yīng)環(huán)節(jié)全部樣品的0.1%和0.4%(見圖7)���。
不符合規(guī)定項目主要涉及鑒別、檢查��、含量測定等,不符合規(guī)定樣品批次依次為9批次�、7批次和4批次,分別占全部不符合規(guī)定項目的45.0%��、35.0%和20.0%(見圖8)����。
不符合規(guī)定產(chǎn)品主要涉及6個劑型,包括散劑(8批次)����、貼膏劑(4批次)、膠囊劑(3批次)���、丸劑(2批次)���、糖漿劑(2批次)、片劑(1批次)��,分別占對應(yīng)劑型全部樣品的5.8%��、0.5%��、0.2%��、0.2%、0.4%��、0.1%(見圖9)�。其中散劑不符合規(guī)定批次占比最高����,不符合規(guī)定項目為鑒別項。
抽檢結(jié)果提示���,藥品生產(chǎn)企業(yè)應(yīng)強化主體責(zé)任意識�,嚴把原藥材質(zhì)量關(guān)�����,從源頭提高產(chǎn)品投料用原料藥材的質(zhì)量�����,加強工藝參數(shù)優(yōu)化�,嚴格按照工藝規(guī)程生產(chǎn),提高產(chǎn)品質(zhì)量的均一性和穩(wěn)定性�。

圖7.中成藥各抽樣環(huán)節(jié)檢驗信息示意圖
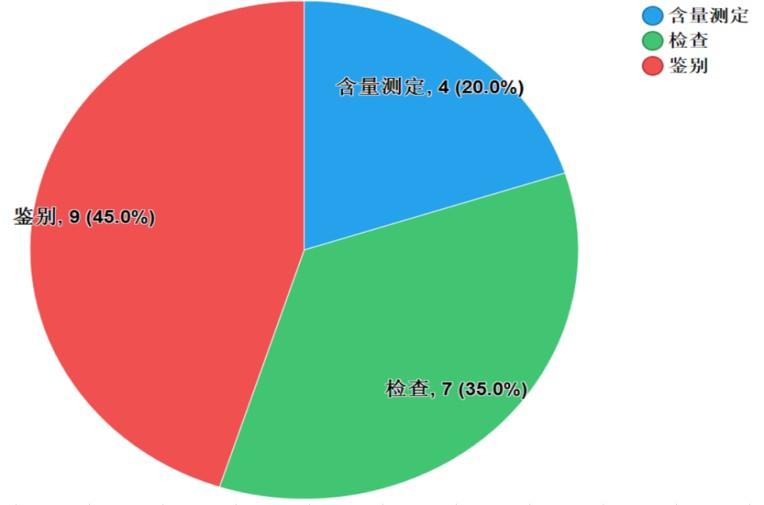
圖8.中成藥不符合規(guī)定項目分布圖
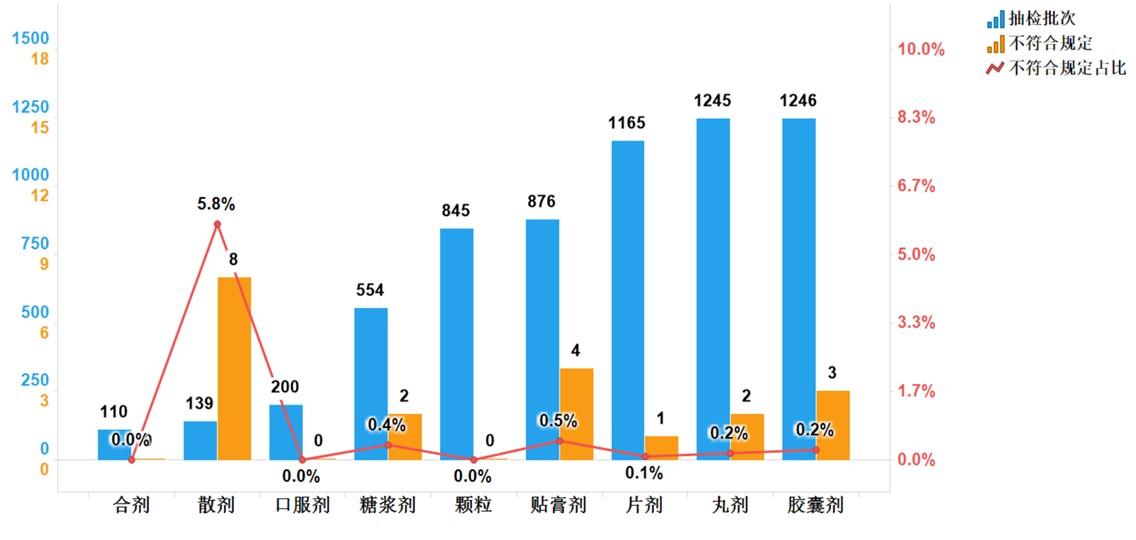
圖9.中成藥各劑型檢驗信息示意圖
3. 生物制品
2021年國家藥品抽檢共抽檢生物制品3個品種64批次,其中生產(chǎn)�、經(jīng)營�、使用環(huán)節(jié)分別抽取43批次�、20批次、1批次�。涉及治療類品種2個,預(yù)防類品種1個�,劑型均為注射劑(見圖10)。經(jīng)檢驗���,所檢項目均符合規(guī)定�,合格率為100%�����。
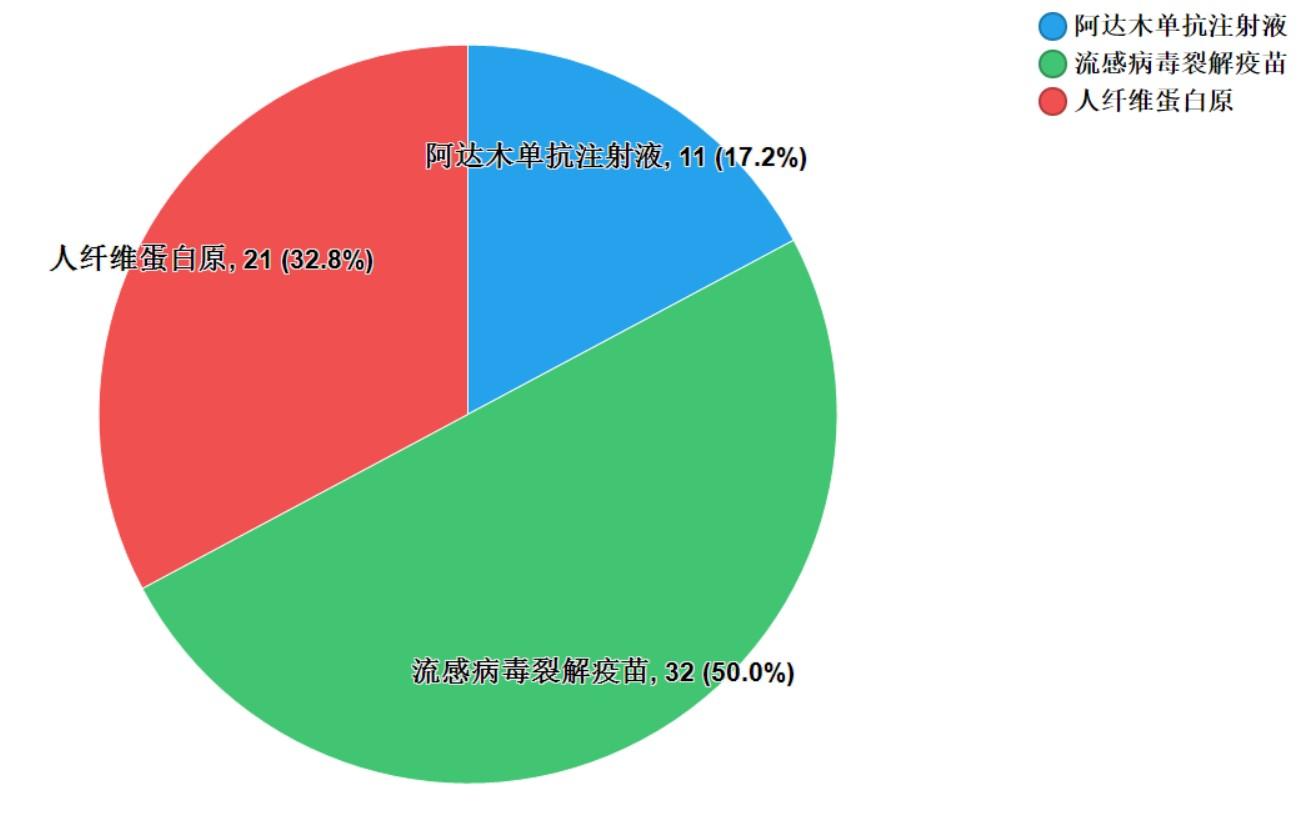
圖10.生物制品抽檢品種信息示意圖
4. 國家基本藥物
2021年國家藥品抽檢共抽檢基本藥物(不含中藥飲片)44個品種6186批次����,在生產(chǎn)、經(jīng)營和使用環(huán)節(jié)各抽取樣品1193批次��、4562批次和431批次���。經(jīng)檢驗�����,不符合規(guī)定6批次��,分別在生產(chǎn)與經(jīng)營環(huán)節(jié)檢出不符合規(guī)定產(chǎn)品1批次和5批次�����,涉及4個劑型��。抽檢結(jié)果顯示����,國家基本藥物整體質(zhì)量狀況較好(見圖11�、12)。
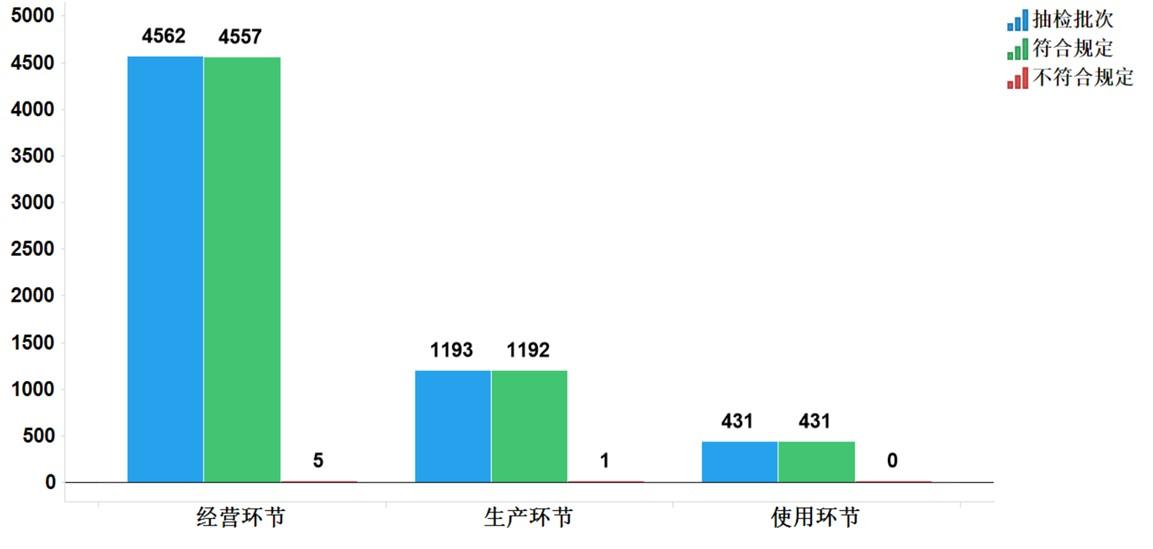
圖11.國家基本藥物各抽樣環(huán)節(jié)檢驗信息示意圖
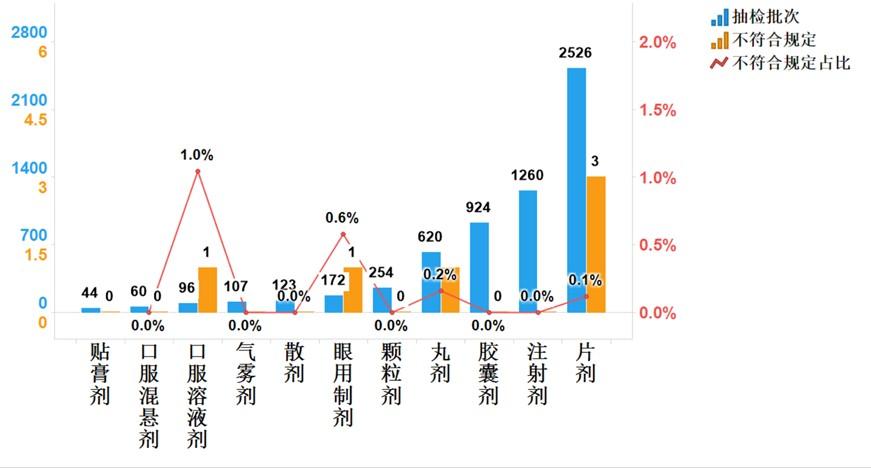
圖12.國家基本藥物各劑型檢驗信息示意圖
5.進口藥品(不含進口中藥材)
2021年�����,國家藥品抽檢共抽檢進口藥品590批次�����,涉及4個劑型(見圖13)�����,其中口岸環(huán)節(jié)232批次、生產(chǎn)環(huán)節(jié)14批次���、經(jīng)營環(huán)節(jié)288批次��、使用環(huán)節(jié)56批次(見圖14)���。經(jīng)檢驗,所檢項目均符合規(guī)定�����,合格率為100%��。
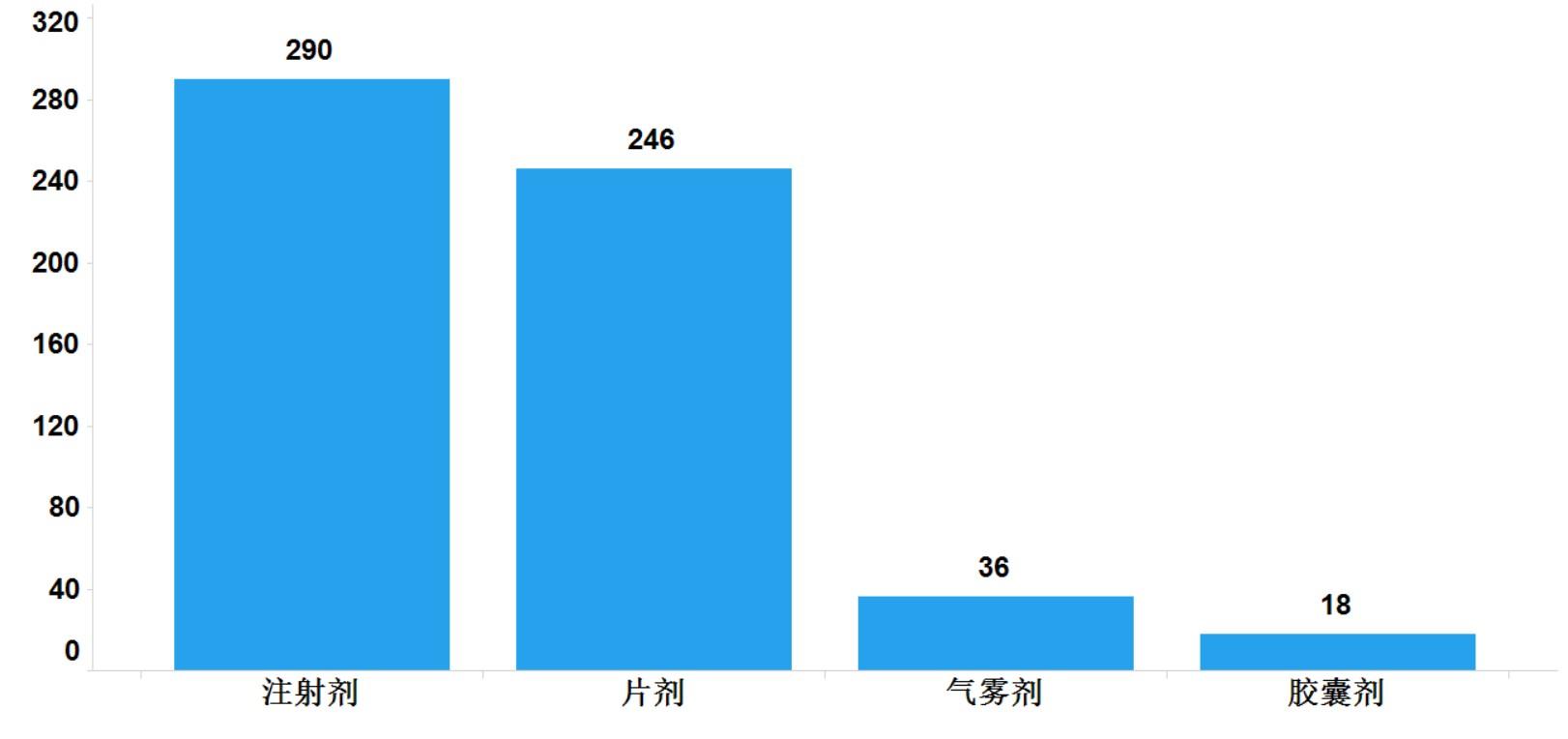
圖13.進口藥品各劑型與抽樣環(huán)節(jié)檢驗信息示意圖
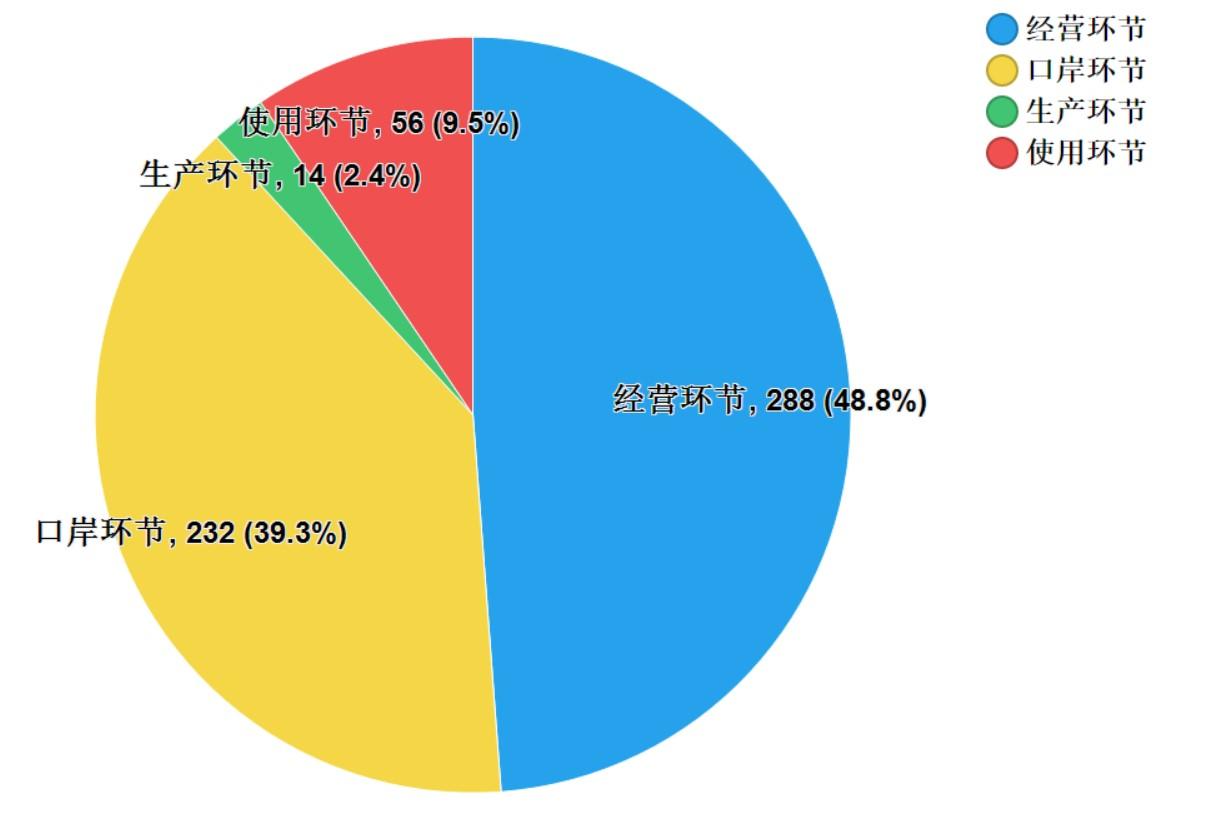
圖14. 進口藥品各抽樣環(huán)節(jié)檢驗信息示意圖
(三)中藥飲片專項抽檢及中藥材質(zhì)量監(jiān)測情況
2021年����,為貫徹落實《中華人民共和國藥品管理法》和《中華人民共和國中醫(yī)藥法》,國家藥監(jiān)局組織開展了中藥飲片專項抽檢及中藥材質(zhì)量監(jiān)測工作�,組織對部分藥品生產(chǎn)企業(yè)、藥材市場集散地或種植集中區(qū)的中藥材質(zhì)量進行監(jiān)測��。
2021年中藥飲片專項抽檢共抽檢9個中藥飲片品種1957批次��,主要針對中藥飲片的安全性方面(如摻假摻偽、違法染色)�,以及質(zhì)量控制(如生產(chǎn)規(guī)范性、專屬性����、二氧化硫、重金屬及農(nóng)殘)等方面開展檢驗和探索性研究���。經(jīng)檢驗��,符合規(guī)定1925批次���,不符合規(guī)定32批次(見圖15)����。不符合規(guī)定項目主要涉及總灰分(2批次)、性狀(18批次)�、雜質(zhì)(11批次)、鑒別(1批次)和含量測定(3批次)等方面����,分別占全部不符合規(guī)定項目的5.7%、51.4%�����、31.4%、2.9%和8.6%(見圖16)�����。2021年中藥材質(zhì)量監(jiān)測共抽取9個品種378批次樣品���,其中��,藥品生產(chǎn)企業(yè)264批次����,市場集散地或種植集中區(qū)114批次�����。所有樣品按照不同品種特點���,針對相應(yīng)項目進行了研究性檢驗�,主要針對摻雜摻偽����、加工炮制規(guī)范、農(nóng)藥殘留、植物生長調(diào)節(jié)劑使用等問題開展�。
2021年中藥飲片專項抽檢及中藥材質(zhì)量監(jiān)測發(fā)現(xiàn)的主要問題有:一是混偽品代用、摻雜問題�,如藏柴胡冒充柴胡、關(guān)蒼術(shù)及雜交蒼術(shù)摻偽冒充蒼術(shù)�����、莧菜子摻偽青葙子等��;二是外源性有害物質(zhì)殘留超限問題�����,部分原料存在真菌毒素污染����、農(nóng)藥殘留污染�����、重金屬及有害元素超標等隱患�,如個別批次蒼術(shù)、木香重金屬殘留��,個別北沙參檢出植物生長調(diào)節(jié)劑;三是采收加工與加工炮制不規(guī)范問題���,如蒼術(shù)由于產(chǎn)地加工泥土去除不完全�,個別樣品總灰分超過標準限度����,柴胡飲片加工過程中地上莖過多導(dǎo)致非藥用部位雜質(zhì)超標。
抽檢結(jié)果及監(jiān)測結(jié)果提示����,我國中藥材及飲片總體質(zhì)量狀況良好。中藥飲片生產(chǎn)企業(yè)應(yīng)提高質(zhì)量控制意識�����,嚴格遵照質(zhì)量標準及炮制規(guī)范要求執(zhí)行����;應(yīng)重視中藥材種植源頭控制質(zhì)量安全問題,規(guī)范種植并加強生產(chǎn)各環(huán)節(jié)質(zhì)量管理����,加強對藥材采收后、飲片炮制加工前的藥材供貨商環(huán)節(jié)的質(zhì)量把控�����,重視貯存環(huán)節(jié)管理,重點關(guān)注摻偽��、有害物質(zhì)殘留等問題����;加強藥材溯源管理,督促藥品生產(chǎn)企業(yè)強化質(zhì)量管理意識���;強化藥材市場監(jiān)測�����,建立健全藥材質(zhì)量長效監(jiān)測機制�����,保證藥材流通質(zhì)量���。
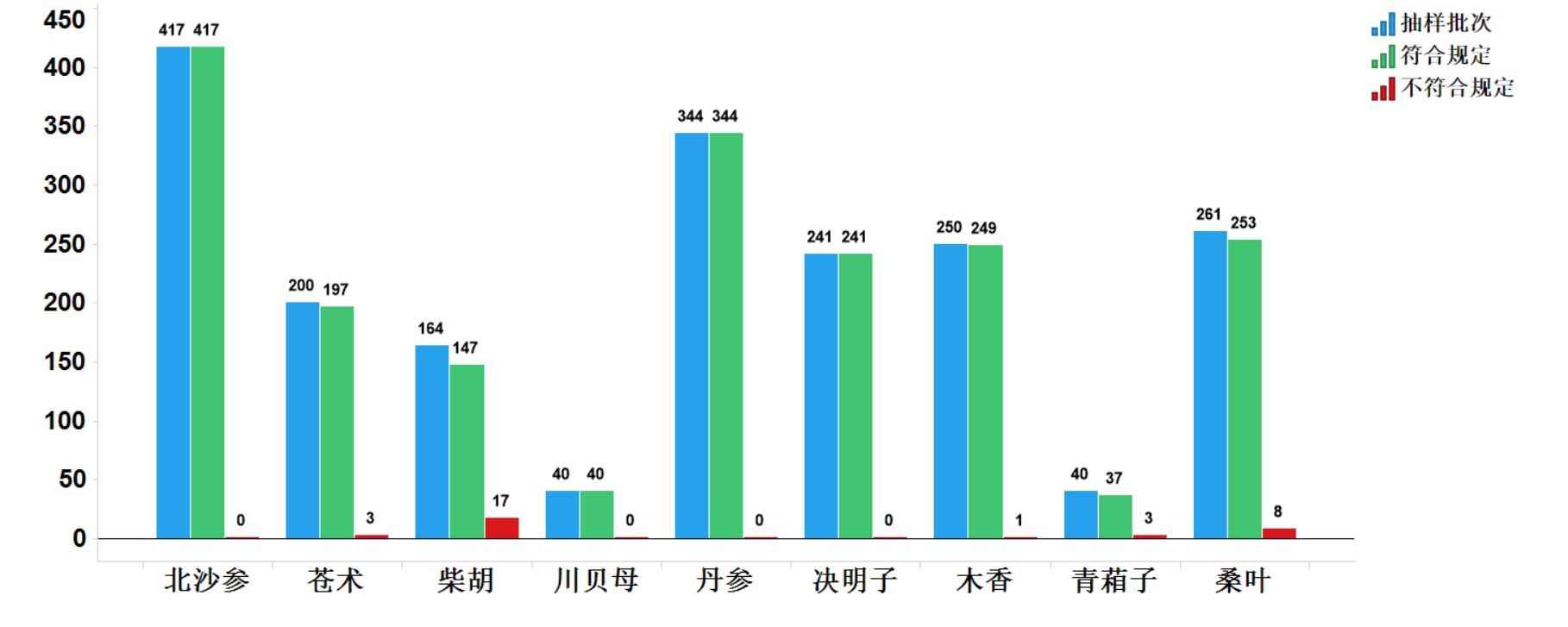
圖15.2021年中藥飲片專項抽檢結(jié)果示意圖
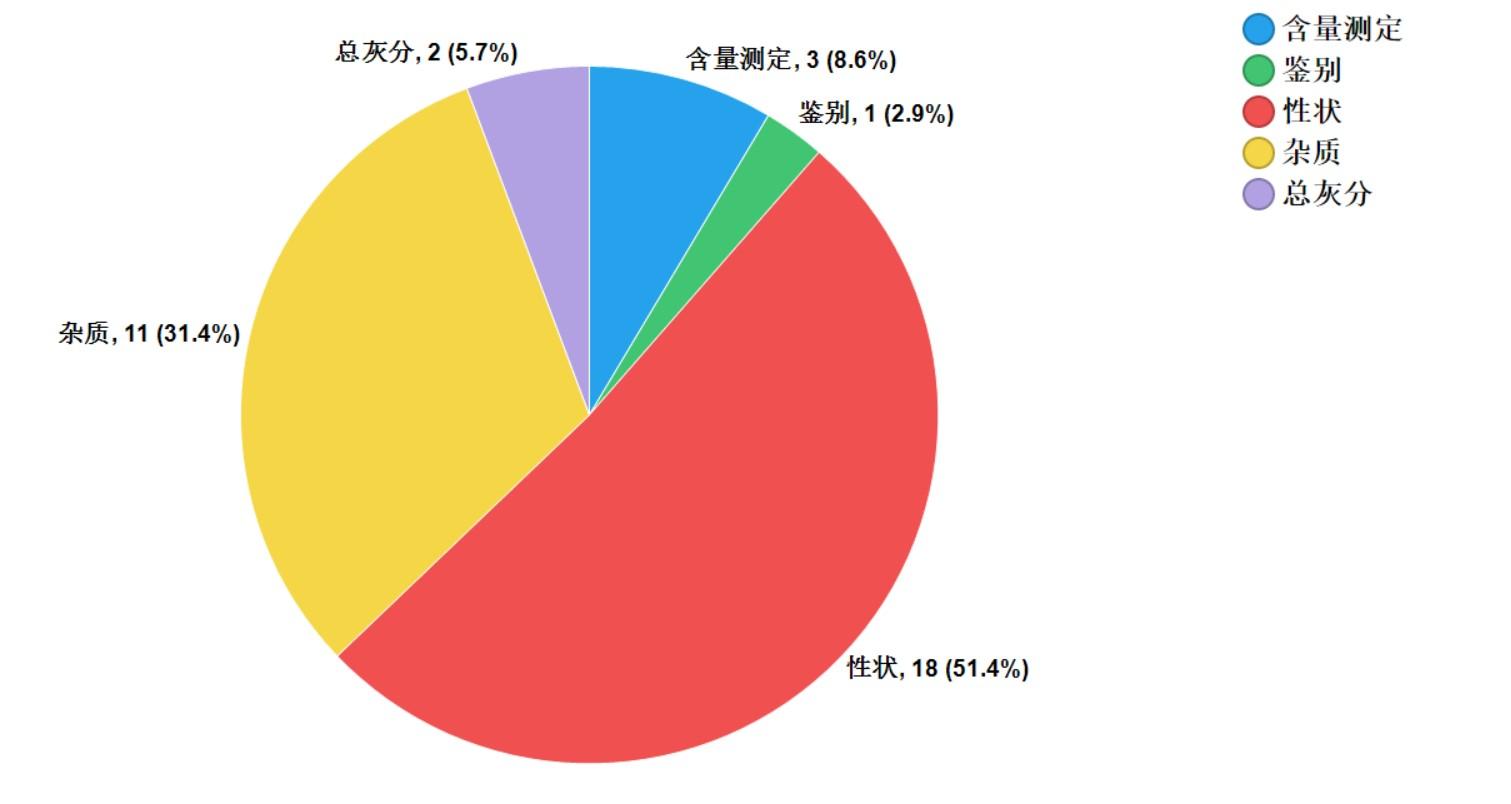
圖16. 2021年中藥飲片專項不符合規(guī)定項目分布圖
注:某些不符合規(guī)定產(chǎn)品涉及多個不符合規(guī)定項目�����。
(四)探索性研究
2021年,各藥品檢驗機構(gòu)在按照現(xiàn)行法定標準檢驗的基礎(chǔ)上�,圍繞抽檢品種可能存在的安全性、有效性問題�����,開展有針對性的探索性研究�,發(fā)現(xiàn)的主要問題有:
一是個別企業(yè)違法違規(guī)生產(chǎn)問題仍然存在,如擅自改變生產(chǎn)工藝��,低限或使用摻偽���、替代品投料�����,違反關(guān)鍵工藝制法�,擅自改變或添加輔料�、防腐劑和抑菌劑等;二是不同廠家因原料藥質(zhì)量差異���、生產(chǎn)工藝不穩(wěn)定等原因�����,導(dǎo)致產(chǎn)品均一性較差�����;三是中藥飲片混用摻偽問題�,如使用質(zhì)量低劣、摻偽的中藥材及飲片生產(chǎn)中藥成方制劑����;四是外源性污染物超限,部分品種重金屬����、農(nóng)藥、防腐劑殘留量超限�����;五是包裝材料相容性問題影響產(chǎn)品質(zhì)量穩(wěn)定性��。
三����、抽檢結(jié)果應(yīng)用
藥品抽檢是藥品上市后監(jiān)管的主要技術(shù)手段,也是實現(xiàn)科學(xué)監(jiān)管��、智慧監(jiān)管的重要技術(shù)支撐�。2021年,隨著國家藥品抽檢制度體系的不斷優(yōu)化創(chuàng)新����,國家藥品抽檢的風(fēng)險防控能力不斷提升、風(fēng)險防控關(guān)口不斷前移����。藥品監(jiān)管部門充分利用國家藥品抽檢結(jié)果,通過有效識別風(fēng)險����、多措并舉打出監(jiān)檢結(jié)合“組合拳”,在震懾不法企業(yè)����、打擊違法違規(guī)、提升藥品質(zhì)量����、以及評價藥品質(zhì)量狀況、警示公眾用藥安全等方面發(fā)揮了重要作用�,正逐步從服務(wù)監(jiān)管的技術(shù)手段向服務(wù)監(jiān)管、服務(wù)產(chǎn)業(yè)�����、服務(wù)公眾的多維度技術(shù)支撐方向擴展。
(一)維持震懾—牢守安全底線
多年來���,國家藥品抽檢通過一定覆蓋面的抽檢規(guī)模�,對不合格產(chǎn)品查控和信息公開��、對風(fēng)險線索核查處置��,對藥品從業(yè)主體形成了強烈震懾�,強化了藥品全生命周期和全過程質(zhì)量控制的意識。
2018~2021年��,國家藥品抽檢總合格率呈穩(wěn)步上升趨勢�,公眾用藥安全得到有效保障。除生物制品每年合格率均在100%以外�����,各類別(化學(xué)藥品��、中成藥���、中藥飲片)合格率也都保持上升趨勢�。例如中藥飲片,國家藥品抽檢總合格率從2017年的89.7%���,提升至2021年的98.4%,隨著持續(xù)加強中藥飲片專項抽檢及信息公開監(jiān)管力度加大����,產(chǎn)業(yè)存在趨向優(yōu)勢集中的態(tài)勢。
近五年來���,通過抽檢等監(jiān)管舉措的不斷實施和強化����,藥品質(zhì)量總體安全形勢平穩(wěn)可控���,藥品質(zhì)量處于較高水平�����,市場環(huán)境持續(xù)向上向好��,藥品抽檢對守住我國藥品質(zhì)量安全底線至關(guān)重要���。
(二)深入排查—查控假劣藥品
2021年�����,國家藥監(jiān)局依照“風(fēng)險控制-依法處置-排查原因并整改-信息公開”的監(jiān)管模式�,確保風(fēng)險關(guān)閉����、警示用藥安全。組織各省級藥品監(jiān)管部門對國家藥品抽檢發(fā)現(xiàn)的70批次不符合規(guī)定產(chǎn)品���,在第一時間采取了查封扣押�����、暫停銷售使用�����、要求企業(yè)主動召回等風(fēng)險控制措施�����;對涉及的相關(guān)企業(yè)和單位均依法組織查處��;同時要求藥品生產(chǎn)企業(yè)認真排查�,督促其查找問題原因并切實整改,確保質(zhì)量安全隱患得到及時有效清除�����。通過藥品抽檢嚴厲打擊了制售假劣藥品的行為���,發(fā)揮了震懾不法企業(yè)、凈化市場環(huán)境的作用���。此外����,國家藥監(jiān)局在2021年共發(fā)布藥品補充檢驗方法12個��,為打擊隱蔽性極強的摻雜摻假等違法行為提供了監(jiān)管利器����,也為企業(yè)提供了保障藥品質(zhì)量安全的科學(xué)依據(jù)。
(三)監(jiān)檢結(jié)合—打擊違法違規(guī)
根據(jù)國家藥品抽檢探索性研究結(jié)果發(fā)現(xiàn)的風(fēng)險線索����,對經(jīng)檢驗合格但涉嫌存在違法違規(guī)行為的,藥品監(jiān)管部門及時開展現(xiàn)場檢查,并根據(jù)檢查結(jié)果采取相應(yīng)的監(jiān)管措施控制系統(tǒng)性風(fēng)險�����,嚴厲打擊個別企業(yè)存在的違法違規(guī)行為�。例如探索性研究發(fā)現(xiàn)部分批次麝香壯骨膏涉嫌存在人為投料錯誤或非法添加麝香草酚等問題,經(jīng)檢查發(fā)現(xiàn)個別企業(yè)存在生產(chǎn)質(zhì)量管理安全隱患�����,物料交叉感染�����,投料原料未全檢驗等問題�。通過抽檢與檢查、稽查執(zhí)法等工作有機銜接���,形成高效協(xié)同的監(jiān)管合力��,個別企業(yè)逃避監(jiān)管的違法違規(guī)的企圖得到有效遏制�,質(zhì)量安全意識逐步增強�。
(四)風(fēng)險提示—推動產(chǎn)業(yè)升級
對于探索性研究發(fā)現(xiàn)的安全風(fēng)險較低、非主觀故意且未涉嫌違法違規(guī)的一般性風(fēng)險信息�����,藥品監(jiān)管部門對相關(guān)企業(yè)進行風(fēng)險提示,督促指導(dǎo)相關(guān)企業(yè)對可能存在的質(zhì)量風(fēng)險因素進行深入排查���、認真整改�。例如�����,在探索性研究中發(fā)現(xiàn)部分批次小兒肺熱寧膠囊易氧化成分含量下降較明顯��,提示聚酯/鋁/聚乙烯藥用復(fù)合膜包裝材料對氧氣的阻隔性能會影響此類制劑的質(zhì)量�;部分批次止咳桃花散的包裝材料對麝香酮的吸附率高達85%�����,不適用于止咳桃花散的包裝���;部分批次奧利司他膠囊同一批次不同包裝間藥品質(zhì)量存在差異及內(nèi)容物顆粒粘黏膠囊殼的情況��,存在生產(chǎn)工藝不合理或控制不到位等問題����。企業(yè)就風(fēng)險提示開展排查、分析和驗證����,采取優(yōu)化生產(chǎn)工藝、提高內(nèi)控標準���、加強原輔包質(zhì)量控制等整改措施��,提升產(chǎn)品質(zhì)量水平�����。
(五)社會共治—助力科學(xué)監(jiān)管
國家藥監(jiān)局繼續(xù)以通告的形式�����,依法及時向公眾發(fā)布不符合規(guī)定產(chǎn)品信息����,筑牢公眾用藥安全防線���,全年共發(fā)布藥品質(zhì)量通告5期�。中檢院持續(xù)在官方網(wǎng)站公開國家藥品抽檢的探索性研究情況��,2021年共發(fā)布102個品種的新建檢驗方法、承檢機構(gòu)及聯(lián)系方式等內(nèi)容����,這種寓服務(wù)于監(jiān)管的模式,有利于促進上市持有人的質(zhì)量安全意識和主體責(zé)任自律意識��,通過信息的共享利用���,針對發(fā)現(xiàn)的藥品質(zhì)量問題和檢驗檢測新技術(shù)進行交流��,促進產(chǎn)品研發(fā)創(chuàng)新升級�。
依托國家藥品抽檢結(jié)果��,2021年9月�����,“藥品質(zhì)量安全年會”以線上形式舉辦�����,搭建檢驗檢測生產(chǎn)研發(fā)機構(gòu)信息交流平臺�����,分析檢驗檢測數(shù)據(jù)��,挖掘質(zhì)量安全問題����,助推藥品產(chǎn)業(yè)發(fā)展提質(zhì)升級,成為行業(yè)內(nèi)獲取藥品質(zhì)量提升信息的重要渠道之一�����。
四���、結(jié)語
2021年國家藥品抽檢工作順利完成�。檢驗及研究結(jié)果顯示�,我國藥品質(zhì)量仍處于較高水平,整體安全形勢平穩(wěn)可控�。
2022年是“十四五”規(guī)劃的起步之年,正值向著全面建成社會主義現(xiàn)代化強國的第二個百年奮斗目標邁進的重大歷史關(guān)頭����。人民藥監(jiān)初心如磐,國家藥監(jiān)局將繼續(xù)堅持人民至上�、保障用藥安全有效、助力保障疫情防控大局�����,不斷推進藥品抽檢制度體系現(xiàn)代化,健全完善藥品抽檢模式��,大力發(fā)展監(jiān)管科學(xué)和智慧監(jiān)管�����,多措并舉提升技術(shù)支撐能力�,堅決守住藥品安全質(zhì)量底線,助力產(chǎn)業(yè)高質(zhì)量發(fā)展�。
小貼士
1.藥品抽檢歷史沿革
1956年,我國首次提出藥品計劃抽檢的概念��;1964年�����,原衛(wèi)生部第一次制定國家級年度藥品抽檢計劃并組織實施��;1984年頒布《中華人民共和國藥品管理法》�,第一次從法律上明確了藥品抽檢工作的地位�;1986年,實行藥品質(zhì)量公報制度�;1990年���,實行藥品抽檢收費制度,即抽檢藥品須由被抽檢單位付檢驗費�����;2001年���,《中華人民共和國藥品管理法》修訂��,取消了藥品抽檢收費制度����,所需費用由財政列支���;2019年����,《中華人民共和國藥品管理法》再次修訂��,明確“藥品監(jiān)督管理部門根據(jù)監(jiān)督管理的需要��,可以對藥品質(zhì)量進行抽查檢驗”“抽樣應(yīng)當(dāng)購買樣品”。
2.藥品標準檢驗
藥品標準檢驗是指具有檢驗資質(zhì)的藥品檢驗機構(gòu)�,依據(jù)國家藥品監(jiān)督管理部門批準的法定檢驗標準中的檢驗方法,進行全項目或部分項目的檢驗����,并依法出具檢驗報告書的過程。
3.探索性研究
探索性研究是指在國家藥品抽檢過程中���,除按照國家藥品標準進行檢驗并判定藥品是否符合標準規(guī)定之外�,針對可能存在的質(zhì)量問題��,應(yīng)用該品種國家藥品標準以外的檢驗項目和檢測方法對藥品質(zhì)量進行進一步分析研究的過程��。探索性研究結(jié)果不作為判定藥品合格與否的依據(jù)���,可為進一步提升藥品質(zhì)量水平�����、加強藥品監(jiān)管提供技術(shù)支持�。
4.國家基本藥物
國家基本藥物是適應(yīng)基本醫(yī)療衛(wèi)生需求�,劑型適宜,價格合理���,能夠保障供應(yīng)����,公眾可公平獲得的藥品����。國家基本藥物目錄是各級醫(yī)療衛(wèi)生機構(gòu)配備使用藥品的依據(jù)?!秶一舅幬锬夸洠?018年版)》中的藥品包括化學(xué)藥品和生物制品、中成藥��、中藥飲片3部分�,其中,化學(xué)藥品和生物制品主要依據(jù)臨床藥理學(xué)分類���,共
417個品種��;中成藥主要依據(jù)功能分類����,共268個品種���;中藥飲片不列具體品種����,頒布國家標準的中藥飲片為國家基本藥物,國家另有規(guī)定的除外���。
5.藥品補充檢驗方法
藥品補充檢驗方法和檢驗項目(藥品補充檢驗方法)適用于有摻雜�、摻假嫌疑����,且國家藥品標準規(guī)定的檢驗方法和檢驗項目不能檢驗的藥品檢驗。經(jīng)國務(wù)院藥品監(jiān)督管理部門批準后����,使用補充檢驗方法和檢驗項目所得出的檢驗結(jié)果,可以作為藥品監(jiān)督管理部門認定藥品質(zhì)量的依據(jù)�����。
6.檢驗項目
性狀項下記載藥品的外觀��、臭���、味����、溶解度以及物理常數(shù)等,在一定程度上反映藥品的質(zhì)量特性�。
鑒別項下規(guī)定的試驗方法,系根據(jù)反映該藥品的某些物理���、化學(xué)或生物學(xué)等特性所進行的藥物鑒別試驗,不完全代表對該藥品化學(xué)結(jié)構(gòu)的確認����。
檢查項下包括反映藥品的安全性與有效性的試驗方法和限度、均一性與純度等制備工藝要求等內(nèi)容����;對于規(guī)定中的各種雜質(zhì)檢查項目,系指該藥品在按既定工藝進行生產(chǎn)和正常貯藏過程中可能含有或產(chǎn)生并需控制的雜質(zhì)(如殘留溶劑�、有關(guān)物質(zhì)等);改變生產(chǎn)工藝時需另考慮增修訂有關(guān)項目��。
含量測定項下規(guī)定的試驗方法�����,用于測定原料及制劑中有效成分的含量���,一般可采用化學(xué)�、儀器或生物測定方法。
附表:2021年國家藥品抽檢品種目錄

(來源:中國食品藥品檢定研究院)