程序性死亡受體-1(PD-1)的基因于1992年由日本科學(xué)家Honjo在小鼠中分離����、鑒定,在經(jīng)歷細(xì)胞死亡的T細(xì)胞雜交瘤中發(fā)現(xiàn)�,因此得名�。PD-1與CTLA-4、CD28和KIRs的結(jié)構(gòu)具有相似性�,人們因此猜測(cè)PD-1的配體可能是B7或MHC I家族成員。在2000年和2001年��,Honjo和Freeman先后發(fā)現(xiàn)了PD-1與PD-L1(CD274����;B7-H1)和PD-L2(CD273���;B7-DC)相互作用的證據(jù),共同闡述了PD-1/PD-L1對(duì)人體T細(xì)胞的調(diào)控作用�����,從而確定了PD-1途徑����。

2002年,耶魯大學(xué)的華人教授陳列平發(fā)表的文章中指出大多數(shù)的腫瘤細(xì)胞通過(guò)表達(dá)PD-L1實(shí)現(xiàn)免疫逃逸��,這為后面PD-1/PD-L1抗腫瘤藥物的研發(fā)提供了重要的理論依據(jù)�����。2014年7月全球首個(gè)PD-1藥物Opdivo在日本上市�,同年12月,第二個(gè)PD-1藥物Keytruda在美國(guó)上市�����,2016年首個(gè)PD-L1抑制劑上市����。隨后默克公司與輝瑞的Bavencio���,阿斯利康PD-L1單抗Imfinzi在2017年上市,2018年Libtayo上市�����,全球目前已有多個(gè)PD-1/PD-L1抑制劑藥物上市���,而處于臨床前或臨床階段的PD-1/PD-L1抑制劑玩家多達(dá)上百個(gè)���。此外,PD-1抑制劑也已成為多種聯(lián)合治療的基石����。因此,進(jìn)一步了解PD-1抑制劑作為單一藥物如何發(fā)揮作用以及在這些不同類(lèi)型的聯(lián)合治療中的作用變得越來(lái)越重要���。
PD-1的信號(hào)通路
PD-1受體是I型跨膜糖蛋白,屬于CD28受體超家族成員�。但與CD28不同,它在細(xì)胞表面是單體�。在結(jié)構(gòu)上,PD-1由細(xì)胞外免疫球蛋白可變結(jié)構(gòu)域、跨膜結(jié)構(gòu)域和負(fù)責(zé)信號(hào)和骨架分子結(jié)合的細(xì)胞質(zhì)尾部組成�����。PD-1的細(xì)胞質(zhì)尾部包含兩個(gè)酪氨酸基序����,一個(gè)ITIM(VDY223GEL)和一個(gè)ITSM(TEY248ATI)。兩個(gè)結(jié)構(gòu)域在PD-1配體結(jié)合時(shí)通過(guò)Lck的酪氨酸激酶活性磷酸化�����。

PD-1在活化的T細(xì)胞和B細(xì)胞�、自然殺傷(NK)細(xì)胞、單核細(xì)胞�����、樹(shù)突狀細(xì)胞和癌細(xì)胞如黑色素瘤上表達(dá)�����。PD-1通過(guò)與PD-L1結(jié)合而被激活�,并且與PD-L2具有更高的親和力。兩者的表達(dá)都是干擾素/細(xì)胞因子誘導(dǎo)的����,但具有特定的表達(dá)模式:PD-L1在造血細(xì)胞和非造血細(xì)胞中廣泛表達(dá)��,而PD-L2主要在APC上表達(dá)�����。
在免疫細(xì)胞中�,PD-1信號(hào)依賴(lài)于酪氨酸磷酸酶SHP-2���。PD-1/SHP-2信號(hào)軸的破壞是腫瘤環(huán)境中對(duì)PD-1抗體產(chǎn)生臨床反應(yīng)的部分原因�。配體結(jié)合后�����,SHP-2被招募到PD-1的磷酸化ITSM�����, ITSM的磷酸化誘導(dǎo)SHP-2向活性構(gòu)象的轉(zhuǎn)換��。對(duì)重建的免疫突觸的顯微鏡觀察表明����,在PD-L1的存在下,PD-1和CD28在TCR富集區(qū)中央發(fā)生關(guān)聯(lián)��。其中PD-1招募SHP-2���,促進(jìn)CD3ζ和CD28磷酸化的降低����,并對(duì)TCR信號(hào)強(qiáng)度產(chǎn)生負(fù)面影響�����。PD-1促進(jìn)的CD28去磷酸化深刻影響TCR信號(hào)體的PI3K募集�,降低PI3K/AKT途徑活性及其轉(zhuǎn)錄靶點(diǎn),如Bcl-xL���。此外�����,SHP-2被認(rèn)為不僅負(fù)責(zé)阻斷CD28共刺激信號(hào)���,而且還負(fù)責(zé)抑制TCR介導(dǎo)的ZAP70磷酸化及其與CD3ζ的關(guān)聯(lián),這些信號(hào)會(huì)導(dǎo)致PKCθ和ERK激活以及下游IL-2的產(chǎn)生和擴(kuò)增����。
PD-1及其配體的作用方式
PD-1配體PD-L1和PD-L2的表達(dá)模式不同�����。PD-L1廣泛表達(dá)于造血細(xì)胞和非造血細(xì)胞���。而PD-L2的表達(dá)比PD-L1更為有限,主要局限于造血細(xì)胞����。PD-L1也在多種腫瘤類(lèi)型的腫瘤細(xì)胞表達(dá);盡管比PD-L1更為有限���,PD-L2也在腫瘤細(xì)胞(如食管腺癌)上被觀察到����。
雖然PD-L1和PD-L2都與PD-1結(jié)合�,但它們都有第二個(gè)不同的相互作用蛋白。PD-L1還可以結(jié)合B7-1(CD80)���,而PD-L2也可以結(jié)合排斥導(dǎo)向分子b(RGMb)���。B7-1主要由造血細(xì)胞和抗原呈遞細(xì)胞表達(dá)����,而RGMb則表達(dá)于巨噬細(xì)胞�、肺泡上皮細(xì)胞����、神經(jīng)組織和各種器官。
PD-1與PD-L1的順式作用
典型的PD-1途徑相互作用發(fā)生在活化T細(xì)胞上表達(dá)的PD-1與腫瘤���、抗原呈遞細(xì)胞(APC)或非造血細(xì)胞上的PD-L1之間的反式相互作用�����,并導(dǎo)致T細(xì)胞活化的抑制��。如果PD-1和PD-L1都表達(dá)在同一細(xì)胞表面���,那么PD-1和PD-L1之間也可以發(fā)生順式作用,并且這種相互作用與反式相互作用具有相似的親和力�。
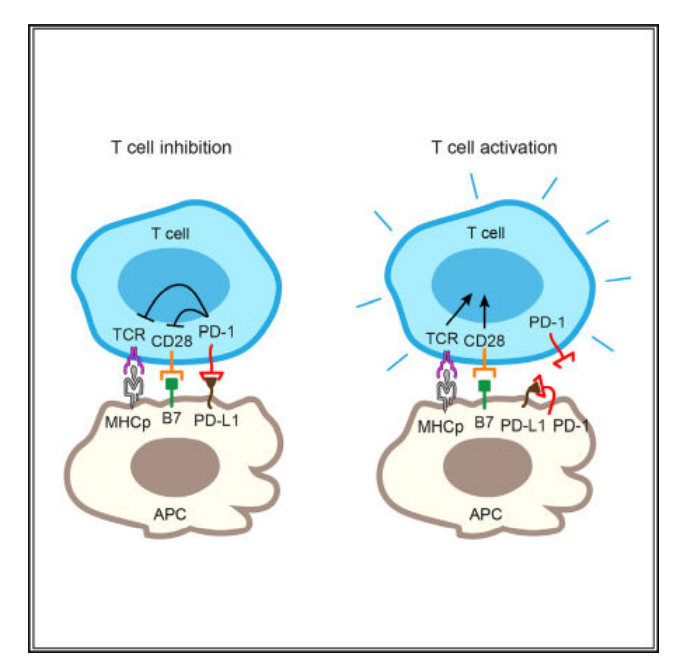
在非小細(xì)胞肺癌等腫瘤中,PD-1可與PD-L1在腫瘤浸潤(rùn)巨噬細(xì)胞��、MDSCs�����、樹(shù)突狀細(xì)胞以及一些腫瘤細(xì)胞亞群上共同表達(dá)。順式相互作用與反式相互作用競(jìng)爭(zhēng)��,導(dǎo)致抑制PD-1信號(hào)的PD-L1更少�����?����?紤]到PD-L1在一些腫瘤浸潤(rùn)淋巴細(xì)胞(TIL)上的表達(dá)�����,PD-L1和PD-1在T細(xì)胞表面也可能發(fā)生順式相互作用��。反式與順式PD-1/PD-L1相互作用的相對(duì)重要性可能取決于它們?cè)谙嗤虿煌?xì)胞表面的相對(duì)豐度����,需要進(jìn)一步仔細(xì)評(píng)估。
PD-L1與B7-1的相互作用
PD-L1可與B7-1結(jié)合�,親和力為1.4μM,約為B7-1對(duì)CD28(4μM)親和力的3倍,但弱于PD-L1與PD-1(0.77μM)或B7-1與CTLA-4(0.2μM)的親和力���。
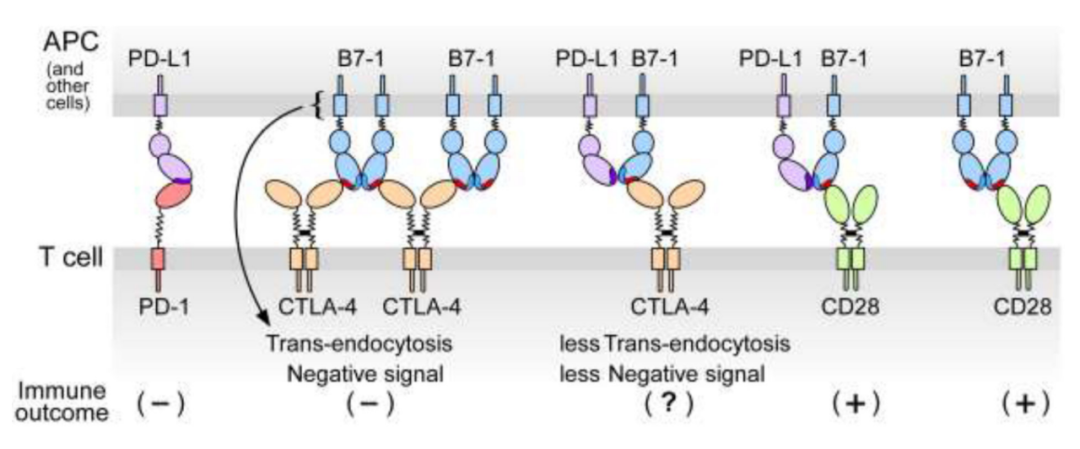
PD-L1與B7-1的相互作用只發(fā)生在同一細(xì)胞表面的順式結(jié)構(gòu)中��。競(jìng)爭(zhēng)結(jié)合研究和突變分析表明�,PD-1和B7-1競(jìng)爭(zhēng)PD-L1上的重疊結(jié)合區(qū)域�。因此,B7-1與PD-L1的結(jié)合阻止了PD-L1與PD-1的相互作用�����,從而減少了PD-1抑制信號(hào)��。
令人驚訝的是�����,B7-1與PD-L1的結(jié)合不會(huì)干擾B7-1與CD28的結(jié)合����;因此�,它們可以形成三聚體復(fù)合物,與CD28共刺激信號(hào)結(jié)合��。PD-L1與B7-1結(jié)合對(duì)CTLA-4與B7-1結(jié)合的影響更為微妙。CTLA-4同型二聚體可以以高親和力與B7-1同型二聚體結(jié)合�����,導(dǎo)致B7-1被Treg反式內(nèi)吞����。PD-L1與B7-1的結(jié)合將CTLA-4相互作用降低為單價(jià),從而顯著降低親和力����。這可以防止B7-1的去除,并減少任何T細(xì)胞固有的CTLA-4信號(hào)�。
大多數(shù)PD-L1單抗都同時(shí)阻斷PD-L1/PD-1和PD-L1/B7-1相互作用。在腫瘤免疫治療中�,這種類(lèi)型的PD-L1單抗通過(guò)增強(qiáng)CTLA-4介導(dǎo)的同型二聚體B7-1的去除,導(dǎo)致APC上B7-1表達(dá)水平降低����。這為PD-L1和CTLA-4聯(lián)合阻斷的臨床試驗(yàn)提供了良好的理論基礎(chǔ)。
PD-L2與RGMb的相互作用
PD-L2與T細(xì)胞上的PD-1結(jié)合抑制T細(xì)胞活化����,PD-L2/PD-1的親和力是PD-L1/PD-1的三倍。它們與PD-1的結(jié)合區(qū)域類(lèi)似���,因此��,PD-L2和PD-L1競(jìng)爭(zhēng)與PD-1的結(jié)合����。雖然PD-L2的親和力高于PD-L1,但其較低的表達(dá)水平為PD-L1/PD-1提供了競(jìng)爭(zhēng)優(yōu)勢(shì)���。
PD-L2的第二個(gè)結(jié)合蛋白是RGMb����,它具有類(lèi)似于PD-L2/PD-1的親和力�。RGMb是一種糖基磷脂酰肌醇(GPI)錨定蛋白�����,PD-L2可能與RGMb超復(fù)合物反式結(jié)合����,以調(diào)節(jié)下游通路。PD-L2在該超復(fù)合物中的功能作用及其影響尚需進(jìn)一步研究����。
PD-1的功能
PD-1對(duì)TCR激活閾值的調(diào)節(jié)決定了T細(xì)胞對(duì)信號(hào)強(qiáng)度的反應(yīng)范圍,從而決定了它們的分化命運(yùn),包括耗竭和記憶形成����。PD-1還在免疫抑制調(diào)節(jié)性T(Treg)細(xì)胞和先天免疫細(xì)胞的激活中發(fā)揮作用。受PD-1信號(hào)影響的這些不同因素決定了癌癥免疫治療反應(yīng)的持續(xù)時(shí)間��。
PD-1決定T細(xì)胞激活閾值
CTL成功激活后��,被激活的T細(xì)胞的命運(yùn)就會(huì)多樣化��。一些細(xì)胞保持其作為效應(yīng)T細(xì)胞的活性��,而另一些細(xì)胞由于過(guò)度刺激而變得無(wú)能����、進(jìn)入耗竭狀態(tài)或發(fā)生凋亡。CTL的PD-1表達(dá)提高了激活信號(hào)的閾值�,并抑制了連續(xù)的過(guò)度刺激。
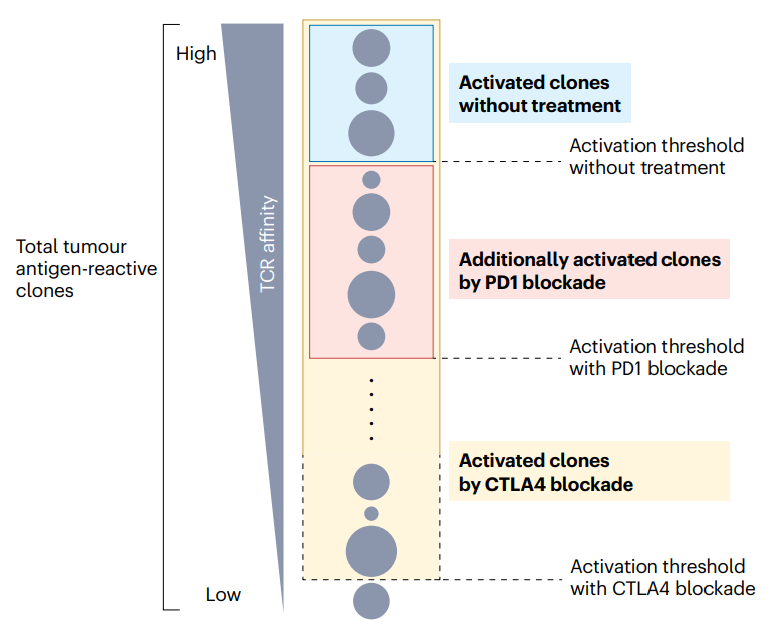
為了增加癌癥免疫治療的持續(xù)時(shí)間���,通過(guò)PD-1阻斷降低激活閾值來(lái)增加T細(xì)胞儲(chǔ)備是至關(guān)重要的�����,這可以增加T細(xì)胞識(shí)別和攻擊腫瘤細(xì)胞的機(jī)會(huì)�����。包括記憶前體在內(nèi)的活化T細(xì)胞的增加也導(dǎo)致長(zhǎng)壽命T細(xì)胞的增多�����,這是持久反應(yīng)的重要因素�。
PD1和記憶T細(xì)胞生成
適應(yīng)性免疫反應(yīng)的標(biāo)志之一是抗原清除后形成免疫記憶。免疫記憶反應(yīng)使宿主在再次遇到相同抗原時(shí)能夠更快地作出反應(yīng)���。PD-1信號(hào)可通過(guò)多種不同機(jī)制影響記憶反應(yīng)�。首先�,TCR信號(hào)的強(qiáng)度與長(zhǎng)壽命中央記憶T細(xì)胞的形成呈負(fù)相關(guān)。因此��,效應(yīng)器期PD-1信號(hào)的丟失將導(dǎo)致更強(qiáng)的TCR信號(hào)��,從而導(dǎo)致記憶T細(xì)胞反應(yīng)受損���。從機(jī)制上講,最近的研究表明����,表達(dá)高水平CD62L的記憶前體細(xì)胞群和對(duì)DNA損傷的反應(yīng)能力的增強(qiáng)對(duì)于長(zhǎng)壽記憶群體的形成非常重要�,而包括PD-1和淋巴細(xì)胞激活基因-3(LAG-3)在內(nèi)的抑制性受體對(duì)于維持這一群體非常重要����。
其次,PD-1通路在調(diào)節(jié)原始T細(xì)胞向記憶T細(xì)胞的分化以及調(diào)節(jié)現(xiàn)有記憶T細(xì)胞群的反應(yīng)方面具有獨(dú)特的作用��。例如��,在CD8+T細(xì)胞對(duì)流感感染反應(yīng)的不同階段使用PD-1抗體的研究表明����,在感染后期(從第21天開(kāi)始)阻斷PD-1通路會(huì)導(dǎo)致記憶性T細(xì)胞數(shù)量增加,并產(chǎn)生炎性細(xì)胞因子IFN-γ和TNF-α�����。此外���,在鼻內(nèi)痘苗病毒應(yīng)答再激發(fā)期間阻斷PD-1可以克服由于缺乏CD4+T細(xì)胞導(dǎo)致的記憶缺陷����。
最后���,PD-1通路影響記憶T細(xì)胞的維持和功能能力可能還取決于環(huán)境�,其機(jī)制目前尚不清楚。因此��,進(jìn)一步闡明PD-1通路參與宿主免疫的宿主因素���,對(duì)于繼續(xù)改善基于PD-1的患者免疫治療至關(guān)重要�����。
PD-1抑制Treg細(xì)胞功能
現(xiàn)在已經(jīng)認(rèn)識(shí)到PD-1可以調(diào)節(jié)傳統(tǒng)αβT細(xì)胞以外的多種細(xì)胞類(lèi)型����。Treg細(xì)胞是一個(gè)特別令人感興趣的群體�,因?yàn)檫@些細(xì)胞在免疫調(diào)節(jié)中起著關(guān)鍵作用。至少有一部分Treg細(xì)胞表達(dá)PD-1受體水平升高�,從而通過(guò)調(diào)節(jié)PD-1通路來(lái)調(diào)節(jié)這一群體。
體外研究發(fā)現(xiàn)�,表達(dá)更高水平PD-1的人類(lèi)Treg細(xì)胞傾向于降低抑制能力并增加IFN-γ的產(chǎn)生。在小鼠模型中�,來(lái)自PD-1缺陷或抗PD-1治療小鼠的Treg細(xì)胞具有更好的抑制能力。在腫瘤中�,PD-1阻斷導(dǎo)致PD-1+CD8+T細(xì)胞功能增強(qiáng)以及PD-1+Treg細(xì)胞介導(dǎo)的免疫抑制增強(qiáng)����。治療開(kāi)始時(shí)��,PD-1+CD8 T細(xì)胞與PD-1+Treg的比率可能會(huì)指導(dǎo)最終免疫反應(yīng)的結(jié)果����。因此��,在檢查這些療法對(duì)患者總體預(yù)后的影響時(shí)���,必須考慮PD-1抑制劑對(duì)這些對(duì)立細(xì)胞群(效應(yīng)細(xì)胞與調(diào)節(jié)細(xì)胞)功能的集體影響�。
PD-1抑制劑在臨床的新用途
2014年����,F(xiàn)DA首次批準(zhǔn)將阻斷PD-1的抗體用于治療晚期或轉(zhuǎn)移性黑色素瘤。自那時(shí)以來(lái)����,阻斷PD-1或PD-L1的抗體已被批準(zhǔn)用于20多種晚期癌癥。常見(jiàn)實(shí)體瘤的總體緩解率(ORR)一般為20-30%����。PD-1或PD-L1藥物在膠質(zhì)母細(xì)胞瘤、微衛(wèi)星穩(wěn)定型結(jié)腸癌���、胰腺癌或前列腺癌中的療效有限���。
鑒于這一成功��,人們期望擴(kuò)大PD-1抑制劑在早期癌癥中的應(yīng)用���,包括新輔助和輔助治療。最初�,在一項(xiàng)針對(duì)21例可切除早期NSCLC患者的小規(guī)模II期試驗(yàn)中,首次評(píng)估了新輔助PD-1阻斷劑對(duì)早期NSCLC的治療作用���。在20名患者中���,有9名(45%)患者出現(xiàn)了主要的病理反應(yīng),即手術(shù)樣本中存活的腫瘤細(xì)胞少于10%���。在9名接受評(píng)估的患者中��,有8名患者在PD-1抑制后發(fā)現(xiàn)腫瘤和血液中T細(xì)胞克隆的多樣性增加����。這些結(jié)果促使了許多更大規(guī)模的新輔助PD-1抑制劑的研究��,包括CheckMate 816、KEYNOTE-671和Impassion030��。
最近����,OpACIN-neo的臨床研究結(jié)果表明�,接受新輔助PD-1或PD-1/CTLA-4聯(lián)合阻斷的局部晚期黑色素瘤患者的病理反應(yīng)率較高。匯總分析發(fā)現(xiàn)�,在52%實(shí)現(xiàn)pCR或近pCR的患者中,2年無(wú)復(fù)發(fā)生存率為96%����,總生存率為100%。這意味著比在輔助治療中接受PD-1或PD-1/CTLA-4聯(lián)合阻斷的患者60%的2年無(wú)復(fù)發(fā)生存率顯著改善�����。當(dāng)考慮到III期黑色素瘤的大多數(shù)復(fù)發(fā)發(fā)生在手術(shù)后的頭兩年內(nèi)時(shí)��,可以進(jìn)一步認(rèn)識(shí)到這一益處的重要性�。此外,OpACIN-neo對(duì)三種給藥方案進(jìn)行了測(cè)試���,發(fā)現(xiàn)較低劑量的ipilimumab治療方案與低irAE發(fā)生率相關(guān)��,同時(shí)保持77%的高病理應(yīng)答率��。
在一項(xiàng)納入II期和III期乳腺癌患者的新輔助治療臨床試驗(yàn)中�,接受PD-1抑制劑和化療的三陰性乳腺癌癌患者手術(shù)時(shí)的pCR率為60%,而僅接受化療的患者為22%���。激素受體陽(yáng)性癌癥患者的pCR發(fā)生率為30%���,而僅接受化療的患者為13%。其他試驗(yàn)也有類(lèi)似的結(jié)果�����,目前正在進(jìn)行評(píng)估早期乳腺癌圍手術(shù)期治療中PD-1抑制的其他III期試驗(yàn)���。
膠質(zhì)母細(xì)胞瘤(GBM)是一種致命的惡性腫瘤���,缺乏有效的治療方法。到目前為止�,PD-1抑制劑在復(fù)發(fā)性膠質(zhì)母細(xì)胞瘤中的試驗(yàn)未能顯示生存益處超過(guò)標(biāo)準(zhǔn)護(hù)理。然而�,最近的研究結(jié)果表明,在新輔助治療環(huán)境中����,PD-1抑制可能有益���。在最近的一項(xiàng)II期研究中,接受新輔助PD-1抑制劑的患者中位總生存期顯著延長(zhǎng)(13.7個(gè)月vs 7.5個(gè)月�����,p=0.04)��,無(wú)進(jìn)展生存期延長(zhǎng)(3.3個(gè)月vs 2.4個(gè)月���,p=0.03)。此外���,在包括乳腺癌和晚期錯(cuò)配修復(fù)缺陷型(MMRd)結(jié)直腸癌中��,PD-1抑制劑新輔助治療都顯示出明顯的臨床獲益�。
小結(jié)
自從30年前PD-1通路首次發(fā)現(xiàn)以來(lái)�,我們?cè)诮沂綪D-1通路的復(fù)雜性方面取得了長(zhǎng)足的進(jìn)步。最近的研究在PD-1及其配體的作用方式���,以及PD-1在調(diào)節(jié)不同分化狀態(tài)的T細(xì)胞方面取得了一些新的見(jiàn)解��,有助于深入了解這一重要免疫調(diào)節(jié)途徑的多方面功能���。對(duì)這些發(fā)現(xiàn)的進(jìn)一步研究將繼續(xù)影響我們對(duì)PD-1途徑的理解�,以及如何有效和安全地將PD-1調(diào)節(jié)應(yīng)用于不同的患者群體���。
(來(lái)源:醫(yī)前沿)