基因治療的概念是在20世紀70年代初提出來的��,最初的概念是引入一個正常的基因來取代一個突變基因���,雖然現在有更多的替代方法�����,如基因編輯和堿基編輯����,但它仍然是我們高度依賴的主要策略之一。
2012年歐洲批準Glybera�����,這是西方國家首個基因治療產品����,也是全球首個針對基因疾病的基因治療。盡管Glylbera在商業(yè)上并不成功���,但它打開了基因治療的大門�。在隨后的幾年里����,一些基因治療產品陸續(xù)涌入市場,Strimvelis于2016年在歐洲獲得批準�,CAR-T療法(Kymriah和Yescarta)和Luxturna分別于2017年獲得美國食品和藥物管理局(FDA)的批準。
據弗若斯特沙利文數據顯示����,2015年以來,全球基因治療行業(yè)開始高速發(fā)展�。到2016年,全球和國內基因治療市場規(guī)模分別為5,040萬美元���、1,500萬元����;2020年全球基因市場規(guī)模有所增長,達到20.8億美元�。據預計�����,2025年�����,全球市場和國內市場將分別達到近305.4億美元和178.9億元��?�;蛑委煶蔀槔^小分子藥物����、抗體藥物之后的生物醫(yī)藥的第三次產業(yè)革命。
基因治療的發(fā)展階段
基因治療從發(fā)明到初步應用以及目前的蓬勃發(fā)展�,經歷了下面的四個階段:
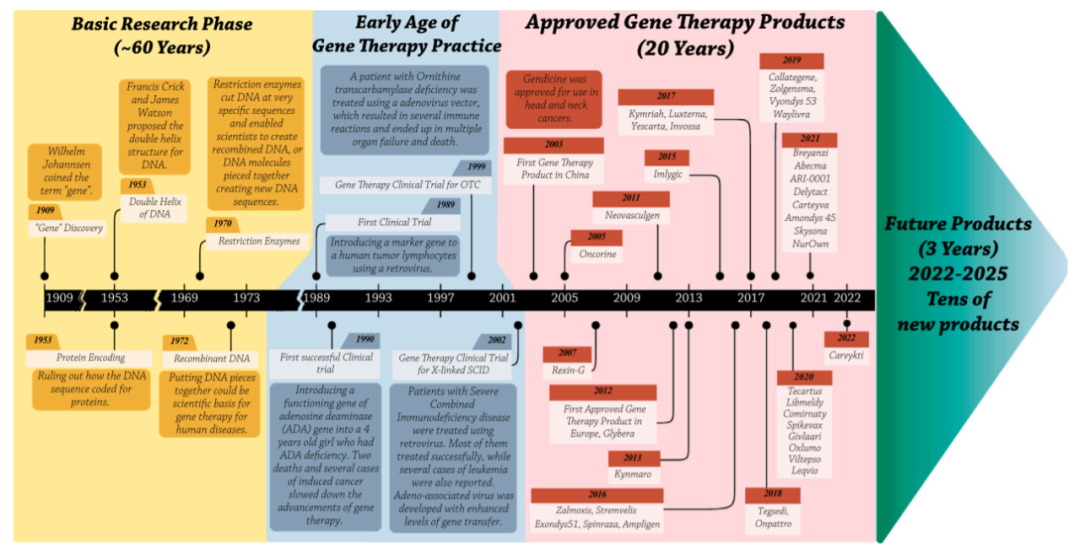
基礎研究階段(1909-1973)
最早,Wilhelm Johannsen創(chuàng)造了“基因”一詞����,然后在大約半個世紀后�����,Francis Crick和James Watson發(fā)現了DNA的雙螺旋結構�����。細菌中基因轉移的基本原理在20世紀60年代被發(fā)現����,隨后被發(fā)展為真核生物轉染技術�����。到20世紀70年代���,限制酶和連接酶的應用構成了基因操縱的基礎���,重組DNA技術使研究人員能夠將選定的治療基因引入工程載體。隨著發(fā)現病毒轉移遺傳物質的能力�����,病毒載體已成為一種有前途的有效基因轉移工具。這些技術進步使科學家能夠創(chuàng)建將特定遺傳物質轉移到靶細胞中的基因治療載體��。
早期的基因治療臨床實踐(1989–2003)
基因治療的第一次臨床實踐開始于1989年��,一種逆轉錄病毒被用于在腫瘤浸潤淋巴細胞上表達新霉素抗性標記物�,該標記物用于黑色素瘤免疫治療中追蹤浸潤淋巴細胞。1990年�,賓夕法尼亞大學的科學家對一名四歲的女孩Ashanti Desilva進行了第一次成功的基因治療臨床試驗。她被診斷為嚴重聯合免疫缺陷(SCID)����,研究人員使用逆轉錄病毒載體將腺苷脫氨酶(ADA)的正?���?截愞D移到她的T細胞。目前她已經可以正常生活�。
然而,病毒載體的使用伴隨著一些不良事件�����,如插入突變和免疫反應����,這阻礙了臨床基因治療的進展�。2000年�,巴黎的歐洲研究人員報告了一項X連鎖SCID基因治療的成功臨床試驗。然而�����,20名接受治療的兒童中有5名在后期發(fā)展為白血病�,這是因為在載體引入轉基因后激活了一種癌基因。與此同時���,1999年��,Jesse Gelsinger�����,一名18歲的男孩����,被診斷患有一種罕見的代謝性疾病���,他自愿成為接受編碼鳥氨酸轉氨酶基因治療的患者���。然而不幸的是��,其因大規(guī)模凝血障礙和隨后的多器官衰竭而死亡����,成為基因治療的第一位死亡患者�。盡管這些挫折減緩了基因治療的進展,但它們也展示了基因治療的潛力及其光明的未來�����。
繁榮發(fā)展階段(2003-2022)
2003年����,中國國家食品藥品監(jiān)督管理局(SFDA)批準了Gendicine�,這是首款用于頭頸部癌癥的基因治療產品。兩年后��,SFDA批準了Oncorine��,這是第一種用于鼻咽癌的溶瘤病毒��。十年后的2012年�����,歐洲藥品管理局(EMA)批準了首個針對脂蛋白脂酶缺乏癥的基因治療產品Glybera,臨床試驗數量幾乎翻了一番���。
首個體外基因治療產品Strimvelis于2016年獲得EMA批準����。2017年��,FDA批準了兩種嵌合抗原受體(CAR)T細胞產品Kymriah和Yescarta���,這是為未來產品鋪平道路的關鍵里程碑�。Luxturna是FDA批準的首個用于Leber先天性黑蒙(LCA)的體內AAV基因治療產品�����,并于2017年獲得批準�。2019年,FDA批準了迄今為止最昂貴的藥物Zolgensma�,這是一種AAV產品,適用于兒童脊髓性肌肉萎縮癥�����。批準的基因治療產品數量每年都在增加。
未來的發(fā)展(2022–2025)
根據之前的臨床試驗和目前批準的產品�,這一前景廣闊的醫(yī)學領域似乎比以往任何時候都發(fā)展得更快,預計在不久的將來會有數十種新的產品獲批����。我們正在逐步將基因治療納入更廣泛的疾病治療領域。
(來源:醫(yī)前沿)