在高度監(jiān)管的生物制藥行業(yè)中,數(shù)據(jù)完整性(DI) 對(duì)于確保滿足產(chǎn)品規(guī)格的決策是準(zhǔn)確的�����、進(jìn)而確?���;颊甙踩彤a(chǎn)品質(zhì)量至關(guān)重要��。隨著行業(yè)越來越多地采用過程分析技術(shù)(PAT)���、高級(jí)自動(dòng)化、高通量微觀研究以及管理由機(jī)器學(xué)習(xí)(ML) 工具創(chuàng)建的數(shù)據(jù)模型��,確保該領(lǐng)域內(nèi)DI 的挑戰(zhàn)變得越來越復(fù)雜��。本文旨在確定隨著行業(yè)向工業(yè)4.0 邁進(jìn)�����,生物制藥生產(chǎn)設(shè)施中的 DI 風(fēng)險(xiǎn)和緩解策略�。為實(shí)現(xiàn)這一目標(biāo),本文總結(jié)了常見的 DI 違規(guī)行為����,并將其與 FDA、EMA和 MHRA 使用的 ALCOA+ 原則聯(lián)系起來��。文章還討論了ISPE GAMP5 和 ISA-95 標(biāo)準(zhǔn)中的相關(guān) DI 指南�,重點(diǎn)關(guān)注經(jīng)過驗(yàn)證的計(jì)算機(jī)化和自動(dòng)化生產(chǎn)系統(tǒng)在避免DI 風(fēng)險(xiǎn)和生成合規(guī)數(shù)據(jù)方面的作用。文章還強(qiáng)調(diào)了DI 在使用數(shù)據(jù)分析��、以確保開發(fā)的模型滿足過程監(jiān)控所需的監(jiān)管標(biāo)準(zhǔn)時(shí)的重要性。這包括討論可能的緩解策略和方法����,以確保針對(duì)智能生產(chǎn)運(yùn)營(yíng)維護(hù)數(shù)據(jù)完整性,例如使用云平臺(tái)來促進(jìn)生產(chǎn)數(shù)據(jù)的存儲(chǔ)和傳輸��,以及擺脫紙質(zhì)記錄�。
產(chǎn)品質(zhì)量、安全性和有效性是生物制藥行業(yè)在生產(chǎn)治療藥物時(shí)的主要關(guān)注點(diǎn)��。通過臨床試驗(yàn)和工藝開發(fā)來證明這些品質(zhì)��,最終獲得上市許可可能需要十多年的時(shí)間�����。監(jiān)管機(jī)構(gòu)需要審查大量數(shù)據(jù)����,以確保良好生產(chǎn)規(guī)范(GMP) 工藝的穩(wěn)健設(shè)計(jì)能夠始終如一地為患者提供高質(zhì)量�、有效和安全的產(chǎn)品。監(jiān)管機(jī)構(gòu)希望所有產(chǎn)品質(zhì)量結(jié)果也符合必要的數(shù)據(jù)完整性(DI) 標(biāo)準(zhǔn)��。高通量平臺(tái)和過程分析技術(shù) (PAT) 等先進(jìn)技術(shù)有助于更好地監(jiān)控和控制過程���,最終確保提高產(chǎn)品質(zhì)量�。這些最近的創(chuàng)新技術(shù)顯著增加了生產(chǎn)過程中生成的數(shù)據(jù)的數(shù)量和復(fù)雜性。數(shù)據(jù)復(fù)雜性的上升促使人們轉(zhuǎn)向使用更復(fù)雜的方法來協(xié)助決策����,例如使用統(tǒng)計(jì)預(yù)測(cè)模型。從如此復(fù)雜的數(shù)據(jù)包中提取信息的需求進(jìn)一步突顯了DI 在生物工藝中的重要性����。DI 也是工業(yè) 4.0 成功不可或缺的一部分,工業(yè)4.0 描述了集成自主實(shí)時(shí)監(jiān)測(cè)和控制����、以提高響應(yīng)能力和靈活性的智能未來工廠。工業(yè)4.0 依賴于對(duì)數(shù)據(jù)管理基礎(chǔ)設(shè)施的更多投資����,例如數(shù)據(jù)湖或數(shù)據(jù)倉(cāng)庫(kù),這些基礎(chǔ)設(shè)施能夠?qū)崿F(xiàn)有效的數(shù)據(jù)存儲(chǔ)和傳輸�,以促進(jìn)信息的傳播。本文將討論DI 的重要性�����,以及如何減輕遵循當(dāng)前良好生產(chǎn)規(guī)范(cGMP) 的生物生產(chǎn)過程中的任何潛在 DI 風(fēng)險(xiǎn)��。
DI標(biāo)準(zhǔn)
DI 被定義為滿足完整性、準(zhǔn)確性和一致性標(biāo)準(zhǔn)的數(shù)據(jù)���。更具體地說���,2013年 FDA 引入了 ALCOA 的首字母縮寫詞,以表明數(shù)據(jù)必須是可歸屬的(attributable)�、清晰的(legible)、同時(shí)的(contemporaneous)���、原始的(original)和準(zhǔn)確的(accurate)�����,此外還要具有持久性和可用性����,這通常被稱為 ALCOA+�。圖 1 總結(jié)并描述了每個(gè)ALCOA+ 元素����,以確保數(shù)據(jù)處理期間的數(shù)據(jù)穩(wěn)健性和可訪問性,幫助加強(qiáng)對(duì)產(chǎn)品應(yīng)用的監(jiān)管審批�。實(shí)施ALCOA+ 可以幫助檢測(cè) DI 風(fēng)險(xiǎn)并避免危及或延遲監(jiān)管產(chǎn)品批準(zhǔn),從而導(dǎo)致工藝時(shí)間和材料的損失;因此���,ALCOA+ 最終可以節(jié)省成本����。
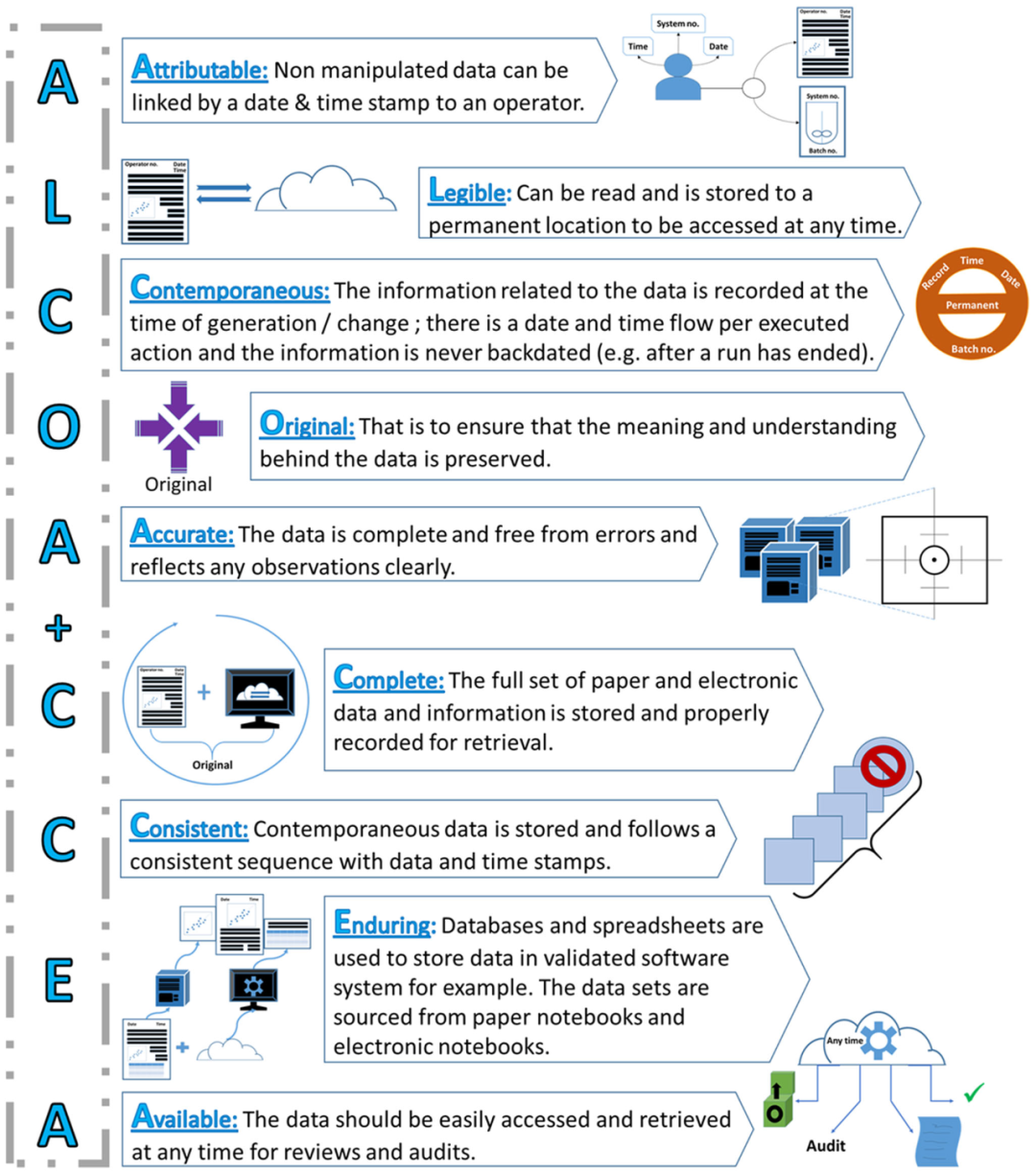
圖1. FDA 的 ALCOA+ 原則及其分解要素描述
DI 法規(guī)和違規(guī)行為
近年來���,監(jiān)管警告信有所增加��,其中43% 涉及可能危及公司監(jiān)管地位的 DI 問題��。除了 ALCOA+ 原則外�����,F(xiàn)DA���、EMA 和MHRA 等監(jiān)管機(jī)構(gòu)也提出了更大的要求,并更新了針對(duì)DI 合規(guī)性的審查和有關(guān)該主題的最新指南�。表 1總結(jié)了從上述監(jiān)管機(jī)構(gòu)整理的主要 DI 指南以及在這些情況下違反 DI 和不遵守ALCOA+ 原則的常見示例。指南涵蓋了從培訓(xùn)員工數(shù)據(jù)處理到檢查內(nèi)部審計(jì)跟蹤和驗(yàn)證控制策略的主題�����。常見的DI 違規(guī)通常與數(shù)據(jù)操縱和偽造有關(guān)。示例包括由于培訓(xùn)不足而導(dǎo)致記錄不完整的文檔����,例如,由于審計(jì)追蹤不足而回溯批次記錄��,以及故意偽造記錄以創(chuàng)建符合目標(biāo)規(guī)范的可接受結(jié)果�����。例如�,2018年,一家亞洲工廠因 HPLC 數(shù)據(jù)不符合規(guī)范而被警告不遵守 cGMP 生產(chǎn)法規(guī)����,并且重新測(cè)試了數(shù)據(jù),但沒有明確說明之前的結(jié)果為何不符合規(guī)范而導(dǎo)致 DI 違規(guī)��。這突出了合理的科學(xué)判斷的重要性�,以證明對(duì)受限數(shù)據(jù)的更改是合理的,并遵守正式文件的規(guī)定�����,以記錄和修改程序�����。
生產(chǎn)系統(tǒng)和 DI - 風(fēng)險(xiǎn)和緩解措施
計(jì)算機(jī)化系統(tǒng)由控制系統(tǒng)(即硬件��、軟件和固件)和網(wǎng)絡(luò)組件組成�,其有助于控制過程,例如創(chuàng)建���、修改和共享數(shù)字信息���。控制系統(tǒng)國(guó)際標(biāo)準(zhǔn)(ISA-95) 旨在定義生產(chǎn)控制功能和其它企業(yè)功能之間交換的電子信息����。圖 2通過疊加 GxP 生物工藝數(shù)據(jù)(即 GLP、GMP和 GDP��,其中 x = 分別為實(shí)驗(yàn)室�、生產(chǎn)和文檔)和用于監(jiān)測(cè)和控制生物反應(yīng)器的儀器的當(dāng)前示例來說明ISA-95 級(jí)別。0 級(jí)描述了生產(chǎn)環(huán)境中的物理生產(chǎn)過程�。1 級(jí)記錄來自傳感器或PAT 工具等儀器的過程數(shù)據(jù)。這些儀器在生物工藝中捕獲的典型數(shù)據(jù)包括在線(例如����,pH或拉曼)���、離線(例如,滴度)���、產(chǎn)品質(zhì)量(例如�����,聚體)和元數(shù)據(jù)(例如��,批號(hào))�����。記錄的數(shù)據(jù)輸入到第 2級(jí)中看到的實(shí)時(shí)過程監(jiān)測(cè)和控制����。這輸入到關(guān)于運(yùn)營(yíng)生產(chǎn)的第 3級(jí)��,例如使用生產(chǎn)執(zhí)行系統(tǒng) (MES)�。最后,業(yè)務(wù)計(jì)劃級(jí)別(第 4 級(jí))概述了可用資金以及系統(tǒng)和設(shè)備的管理�����,這些系統(tǒng)和設(shè)備旨在在設(shè)定的時(shí)間范圍內(nèi)為患者生產(chǎn)高質(zhì)量的產(chǎn)品。

圖2. ISA-95 五層框架�,用于與 GMP 生物工藝生產(chǎn)相關(guān)的計(jì)算機(jī)化系統(tǒng)�����,并附有在每個(gè)相應(yīng)層下描述的示例列表�����。
計(jì)算機(jī)化系統(tǒng)帶來了一些 DI 挑戰(zhàn)��,但是�,問題通常源于對(duì)復(fù)雜數(shù)據(jù)記錄(例如 PAT 記錄)的不當(dāng)管理以及未能驗(yàn)證使用中的系統(tǒng)。隨著生物制藥生產(chǎn)設(shè)施使用更多的計(jì)算機(jī)化系統(tǒng)����,需要從傳統(tǒng)的紙質(zhì)方法轉(zhuǎn)變?yōu)橥耆娮踊南到y(tǒng),以減輕與容易出錯(cuò)的任務(wù)(例如手動(dòng)pH 記錄)相關(guān)的風(fēng)險(xiǎn)并簡(jiǎn)化文檔���。為了生成符合DI 的數(shù)據(jù)�����,必須對(duì)軟件進(jìn)行質(zhì)量檢查���,以在將其應(yīng)用于GxP 環(huán)境之前驗(yàn)證和確認(rèn)控制策略的預(yù)期用途�����。減少DI 問題的另一種方法是通過頻繁的內(nèi)部審計(jì)和記錄審查(例如����,系統(tǒng)日志)���,它可以識(shí)別不符合DI 的區(qū)域并啟用緩解措施�。擁有強(qiáng)大的IT 基礎(chǔ)架構(gòu)有助于簡(jiǎn)化數(shù)據(jù)審查流程并有效管理數(shù)據(jù)存儲(chǔ)�、傳輸和備份。因此��,缺乏強(qiáng)大的基礎(chǔ)架構(gòu)會(huì)給生產(chǎn)流程的連續(xù)性以及最終產(chǎn)品的成功帶來風(fēng)險(xiǎn)����,如果系統(tǒng)出現(xiàn)故障的話。
因此��,需建立良好的自動(dòng)化生產(chǎn)規(guī)范(GAMP)���,以提供一種基于風(fēng)險(xiǎn)的方法��,從而在工業(yè)中實(shí)現(xiàn)合規(guī)的GxP 計(jì)算機(jī)化系統(tǒng)����,其中包括滿足 DI 法規(guī)。GAMP5(2008年更新)與 ISA-95 一起可以幫助科學(xué)家和工程師生成數(shù)據(jù)和系統(tǒng)并與之交互��。更多文件����,如 GAMP 的 “2020 DI by design” 和2017 DI 指南也已發(fā)布����,以提供進(jìn)一步理解并制定更好的與DI 風(fēng)險(xiǎn)相關(guān)的緩解策略?���?偟膩碚f,這些指南清楚地表明需要經(jīng)過驗(yàn)證的系統(tǒng)來生成過程監(jiān)控所需的合規(guī)數(shù)據(jù)�,此外還需要針對(duì)手動(dòng)和電子表單進(jìn)行GDP 培訓(xùn)。GxP 流程培訓(xùn)必須包含全面的解釋以及與法規(guī)的鏈接��,以創(chuàng)建披露和避免 DI 問題的公司文化���,例如����,使用經(jīng)過驗(yàn)證的表格和模板。還必須向操作員提供文件�����,例如標(biāo)準(zhǔn)操作程序(SOP)��,以確保執(zhí)行一致的方法��、適當(dāng)管理數(shù)據(jù)并降低DI 風(fēng)險(xiǎn)���。這些指南允許科學(xué)家和質(zhì)量人員通過創(chuàng)建原型��、規(guī)范和行動(dòng)計(jì)劃來提高標(biāo)準(zhǔn)化����,從而加快快速有效的問題解決和支持�。
工藝設(shè)施由從不同供應(yīng)商購(gòu)買并在不同規(guī)模上工作的各種計(jì)算機(jī)化系統(tǒng)組成。因此���,使用的不同分析系統(tǒng)將存儲(chǔ)和生成不同格式的數(shù)據(jù)�����,例如CSV 和 txt 文件�。使用多種不一致的數(shù)據(jù)格式是該行業(yè)的主要限制,需要做更多的工作來標(biāo)準(zhǔn)化這些數(shù)據(jù)格式�����。為了分析這些數(shù)據(jù)集���,需要進(jìn)行預(yù)處理和操作��,以產(chǎn)生分析師可讀的結(jié)果。Allotrope Foundation 提供了一種解決方案����,該解決方案使用標(biāo)準(zhǔn)數(shù)據(jù)框架,便于將分析數(shù)據(jù)存儲(chǔ)���、使用和集成到單個(gè)文件中�,而不管數(shù)據(jù)復(fù)雜性如何��,以幫助避免數(shù)據(jù)丟失和誤解風(fēng)險(xiǎn)�。此類數(shù)據(jù)框架還提供元數(shù)據(jù)的集成和可追溯性(例如,細(xì)胞接種液、細(xì)胞類型和起泡問題)�����,可以提供必要的數(shù)據(jù)背景�����。記錄元數(shù)據(jù)至關(guān)重要�,因?yàn)樗蹲搅藢?shí)驗(yàn)的本質(zhì)和目的,簡(jiǎn)化了分析�����,并有助于利用對(duì)更好的過程控制和產(chǎn)品質(zhì)量保證所必需的更深入的理解���。
工業(yè) 4.0 - 數(shù)據(jù)分析和智能生產(chǎn)解決方案對(duì) DI 的影響
自動(dòng)化和數(shù)字化正在推動(dòng)由工業(yè) 4.0 管理的智能生產(chǎn)解決方案�。這些需要持久的計(jì)算機(jī)化系統(tǒng)來繼續(xù)生產(chǎn)高效�����、優(yōu)質(zhì)的治療藥物�。高級(jí)PAT 使用的增加進(jìn)一步增加了生成的多維數(shù)據(jù)的復(fù)雜性和數(shù)量,這需要額外的處理��、模型生成和存儲(chǔ)。因此��,越來越需要使用機(jī)器學(xué)習(xí)(ML) 等建模工具,包括多變量數(shù)據(jù)分析 (MVDA)��、機(jī)械模型和混合建模技術(shù)�,以利用來自這些數(shù)據(jù)的洞察力。同樣��,所有處理的數(shù)據(jù)分析模型和數(shù)據(jù)包都必須符合DI 標(biāo)準(zhǔn)����。生成的數(shù)據(jù)要么以未經(jīng)編輯的原始形式記錄��,例如原始CSV 文件���,要么以經(jīng)過處理的形式記錄�����,例如通過模型重組和擬合的數(shù)據(jù)���。重要的是要注意原始數(shù)據(jù)必須始終安全存檔��,并在驗(yàn)證期間提供給監(jiān)管機(jī)構(gòu)檢查���,以確保符合DI 標(biāo)準(zhǔn)。因此�,存儲(chǔ)、傳輸和處理的數(shù)據(jù)和方法必須經(jīng)過驗(yàn)證和記錄��,以確保數(shù)據(jù)的準(zhǔn)確性和完整性得以保留��。將PAT 工具與先進(jìn)的 ML 技術(shù)結(jié)合使用���,可用于提取隱藏信息并獲得進(jìn)一步的理解���,用于更好的監(jiān)控和控制。FDA 鼓勵(lì)實(shí)施這些創(chuàng)新工具�,并允許以可比性方案提交 PAT 數(shù)據(jù),以驗(yàn)證工藝實(shí)施策略和時(shí)間表�。同樣,可以實(shí)施旨在識(shí)別��、調(diào)查和了解過程偏差等問題的根本原因的糾正和預(yù)防措施(CAPA) 的監(jiān)管概念,以防止再次發(fā)生����。GMP 環(huán)境將受益于集成 CAPA 程序,以預(yù)測(cè)哪些過程可能會(huì)受到影響��,并導(dǎo)致代價(jià)高昂的延誤或更嚴(yán)重的產(chǎn)品報(bào)廢�。
數(shù)據(jù)分析可用于通過 ML 工具和高級(jí)數(shù)據(jù)分析來預(yù)測(cè)新出現(xiàn)的問題,以估計(jì)和推薦適當(dāng)?shù)慕鉀Q方案�,但確保處理的數(shù)據(jù)符合DI 標(biāo)準(zhǔn)至關(guān)重要��。數(shù)據(jù)分析還有可能減少偏差和失敗的批次運(yùn)行,最終改善過程控制并縮短開發(fā)時(shí)間���。因此�����,在GMP 級(jí)別使用數(shù)據(jù)分析必須由在早期階段開發(fā)和驗(yàn)證的模型管理,這些模型也符合商業(yè)GMP 生產(chǎn)的 DI 標(biāo)準(zhǔn)��。需要在開發(fā)的早期階段確保滿足 DI 標(biāo)準(zhǔn)并在整個(gè)擴(kuò)大活動(dòng)中保持,以最大限度地減少 GMP 環(huán)境中的進(jìn)一步 DI 風(fēng)險(xiǎn)�����。GMP數(shù)據(jù)分析的一個(gè)挑戰(zhàn)是記錄的數(shù)據(jù)類型�����,例如��,從在線pH 或 DO 傳感器生成的時(shí)間序列數(shù)據(jù)代表一種高頻數(shù)據(jù)采集形式����;這通常需要復(fù)雜的動(dòng)態(tài)模型來提取有用的相關(guān)性。因此���,確保這些復(fù)雜的數(shù)據(jù)包符合DI 標(biāo)準(zhǔn)尤為重要��。數(shù)據(jù)驅(qū)動(dòng)的智能生產(chǎn)可以幫助實(shí)現(xiàn)覆蓋不同生產(chǎn)站點(diǎn)的有效數(shù)據(jù)和資源管理��。云平臺(tái)等智能生產(chǎn)解決方案可以提高安全性和可訪問性,將大量復(fù)雜數(shù)據(jù)安全地存儲(chǔ)和傳輸?shù)絾蝹€(gè)服務(wù)器上����,從而在整個(gè)處理過程中保留其DI。例如���,基于云的 ELN 改進(jìn)了實(shí)驗(yàn)物流工作流程��,并且與管理手動(dòng)日志的價(jià)格范圍相同��。然而�����,這需要一個(gè)復(fù)雜的內(nèi)置基礎(chǔ)設(shè)施來促進(jìn)安全的內(nèi)部網(wǎng)和外部網(wǎng)等功能��,此外還需要安全的互聯(lián)網(wǎng)連接��,以與受信任的云提供商進(jìn)行通信。使用云平臺(tái)會(huì)帶來與數(shù)據(jù)傳輸����、數(shù)據(jù)所有權(quán)和訪問權(quán)的相關(guān)風(fēng)險(xiǎn)�����,特別是在全球化生物制藥公司在不同國(guó)家擁有多個(gè)站點(diǎn)的情況下,這些公司可能受不同的數(shù)據(jù)合規(guī)性法規(guī)的約束��。防止數(shù)據(jù)和系統(tǒng)盜竊的一種方法是設(shè)置適當(dāng)?shù)木W(wǎng)絡(luò)安全措施�,以防止黑客攻擊和數(shù)據(jù)盜竊�。這對(duì)于在家工作的人提供更多遠(yuǎn)程訪問至關(guān)重要,因此需要兩點(diǎn)身份驗(yàn)證�,以確保在用戶和數(shù)據(jù)源之間建立安全連接。最重要的是�����,智能生產(chǎn)面臨的挑戰(zhàn)是快速和安全的網(wǎng)絡(luò)連接的可用性�����,以實(shí)現(xiàn)所需的短延遲時(shí)間����,以提供實(shí)時(shí)監(jiān)控功能。這一點(diǎn)至關(guān)重要����,因?yàn)樾枰⒓丛L問存儲(chǔ)在云中的數(shù)據(jù)�����,以進(jìn)行有效的實(shí)時(shí)監(jiān)控���。圖 3總結(jié)并說明了上述工業(yè) 4.0 中滿足特定于生物反應(yīng)器的 DI 標(biāo)準(zhǔn)的解決方案�����。生物反應(yīng)器應(yīng)配備經(jīng)過驗(yàn)證和確認(rèn)的軟件、固件和控制策略����。此外,還需要SOP,例如校準(zhǔn)探頭和運(yùn)行維護(hù)�����,以滿足適合過程監(jiān)測(cè)和控制的合規(guī)性要求��。捕獲的所有數(shù)據(jù),例如標(biāo)準(zhǔn)傳感器測(cè)量值(例如,pH和 DO)、離線分析和其它高級(jí) PAT 傳感器數(shù)據(jù)(例如���,來自拉曼光譜)都以未經(jīng)編輯的原始形式記錄和存儲(chǔ)�。然后使用數(shù)據(jù)分析對(duì)原始數(shù)據(jù)的副本進(jìn)行預(yù)處理和處理�����,例如在研發(fā)期間開發(fā)并驗(yàn)證用于大規(guī)模監(jiān)測(cè)和控制的ML 工具,然后將其部署在 GMP 生產(chǎn)環(huán)境中�����。確保記錄所有數(shù)據(jù)和模型操作是關(guān)鍵���。為確保生物反應(yīng)器運(yùn)行期間和運(yùn)行后的DI 合規(guī)性,必須適當(dāng)存儲(chǔ)頻繁的內(nèi)部審計(jì)和記錄的錯(cuò)誤記錄�。一旦數(shù)據(jù)被存儲(chǔ)和歸檔,就可以通過實(shí)時(shí)監(jiān)測(cè)和控制策略執(zhí)行在線分析�,從而實(shí)現(xiàn)智能生產(chǎn)。
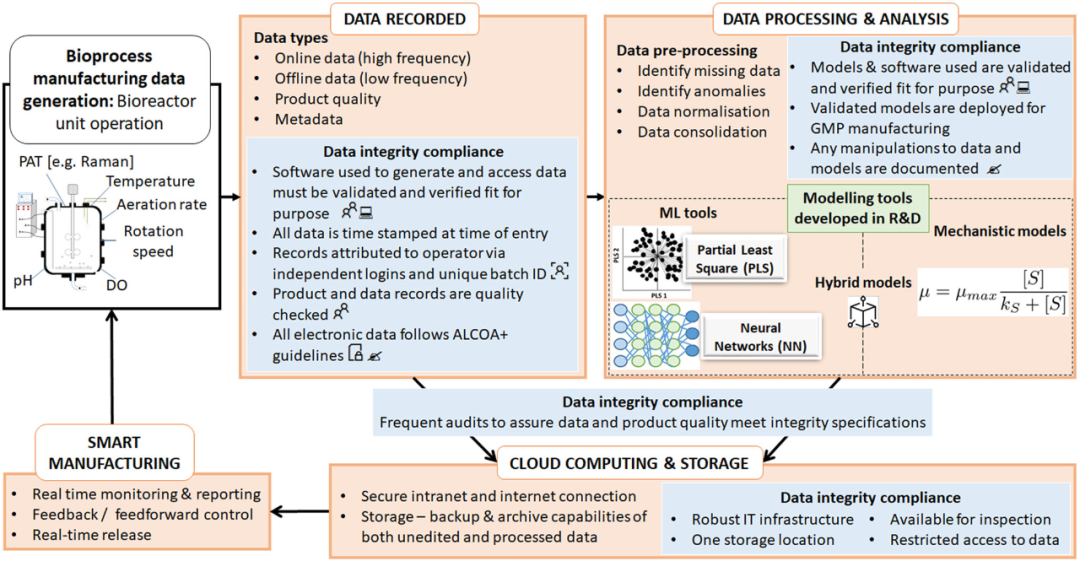
圖3.在特定于生物反應(yīng)器的數(shù)據(jù)生命周期中����,確保工業(yè) 4.0 生物工藝中數(shù)據(jù)完整性所需的必要步驟。這包括使用智能生產(chǎn)方法記錄�����、處理和產(chǎn)生生物過程監(jiān)測(cè)和控制的合規(guī)結(jié)果的先進(jìn)技術(shù)���。
降低 DI 風(fēng)險(xiǎn)的未來措施
隨著生物制藥行業(yè)在數(shù)字化方面變得更加成熟并邁向工業(yè)4.0��,考慮采取進(jìn)一步措施降低 DI 風(fēng)險(xiǎn)至關(guān)重要��。建議使用獨(dú)立登錄作為識(shí)別簽名����,即使是在共享系統(tǒng)上,也可以在監(jiān)管審計(jì)期間使數(shù)據(jù)具有歸屬性和可追溯性����。未來的解決方案還考慮了區(qū)塊鏈應(yīng)用,它依賴于對(duì)生成的數(shù)據(jù)進(jìn)行多步驗(yàn)證�����,以確保數(shù)據(jù)的可追溯性���、透明度和安全性��。這種方法是一種安全的設(shè)計(jì)方法��,允許將生產(chǎn)數(shù)據(jù)存儲(chǔ)在一個(gè)“廉潔”的環(huán)境中����,具有所有相應(yīng)轉(zhuǎn)換和相關(guān)時(shí)間戳���。另一種解決方案是內(nèi)部審計(jì)���,它有助于跟蹤實(shí)施的程序���、行動(dòng)計(jì)劃和控制措施,以確定是否需要重新認(rèn)證或及早標(biāo)記DI 違規(guī)行為����。內(nèi)部審計(jì)也將有助于在使用數(shù)據(jù)分析工具時(shí)保留DI,同樣限制訪問和不可逆的記錄方法也將有助于保留DI����,特別是在需要更改規(guī)范和設(shè)置過程參數(shù)時(shí)����。受監(jiān)控的連接也可用于監(jiān)控使用和跟蹤登錄,這也有助于在檢查期間跟蹤異常情況并標(biāo)記對(duì)原始數(shù)據(jù)包的違規(guī)行為����。建議使用電子批次記錄或?qū)嶒?yàn)室信息管理(LIMS) 系統(tǒng)來自動(dòng)保存電子條目。此外����,對(duì)記錄在便攜式平板電腦上的手動(dòng)表單使用編號(hào)和受控的表格還可以幫助進(jìn)行質(zhì)量檢查���,例如避免由于筆跡不佳而導(dǎo)致的信息丟失。為了滿足ALCOA+ 原則���,該行業(yè)正在轉(zhuǎn)向更先進(jìn)的自主錄音系統(tǒng)��,例如使用數(shù)碼照片集成實(shí)驗(yàn)室語音系統(tǒng)����。上述解決方案很有前景�����,特別是因?yàn)樗兄谟涗浽试S同時(shí)記錄數(shù)據(jù)的文檔����。但是,如果不通過使用嚴(yán)格的內(nèi)部網(wǎng)共享等措施進(jìn)行適當(dāng)?shù)逆i定和控制���,這些電子記錄很容易受到安全漏洞的影響�����。因此���,在不久的將來����,使用具有正確基礎(chǔ)設(shè)施�����、存儲(chǔ)服務(wù)器和相關(guān)監(jiān)管資質(zhì)的新技術(shù)可以減輕GxP 記錄中的一些 DI 風(fēng)險(xiǎn)�����。
總結(jié)
遵守 DI 標(biāo)準(zhǔn)是質(zhì)量保證程序的核心部分�,有助于生物制藥公司確保其產(chǎn)品的一致產(chǎn)品質(zhì)量、功效和安全性����。FDA 的 ALCOA+ 指南等標(biāo)準(zhǔn)已經(jīng)發(fā)布��,以幫助生物制藥行業(yè)的人員評(píng)估和減輕 DI 風(fēng)險(xiǎn)并避免代價(jià)高昂的監(jiān)管產(chǎn)品拒絕��。隨著行業(yè)向工業(yè) 4.0 轉(zhuǎn)變����,DI 的重要性將變得更加重要�����,以實(shí)現(xiàn)依賴數(shù)字集成和數(shù)據(jù)分析的智能工廠的愿景���。本文突出了研發(fā)和GMP 生產(chǎn)領(lǐng)域可能違反 DI 標(biāo)準(zhǔn)的領(lǐng)域,其中包括使用更先進(jìn)的工具���,如 PAT��、數(shù)據(jù)分析和云計(jì)算����。本文還提出了一些緩解措施�,以盡量減少和避免所討論的潛在 DI 違規(guī)行為。
(來源:生物工藝與技術(shù))