目前�����,在一些疾病領(lǐng)域還缺乏適用于兒童的劑型和產(chǎn)品���,兒童用藥(以下簡稱“兒藥”)短缺已經(jīng)成為全世界醫(yī)藥行業(yè)、藥政當(dāng)局和患者關(guān)注的共性問題����,即使是在藥品研發(fā)、生產(chǎn)�、監(jiān)管水平較高的美國,也有超過75%的藥品缺少兒藥信息�,尤其是說明書上缺少明確標(biāo)注兒童以體重或年齡計(jì)算的用法用量,因此藥品被不科學(xué)地減量給兒童使用已經(jīng)成為國內(nèi)外兒童用藥的普遍特征��。
長期以來�����,兒藥開發(fā)及市場價(jià)值被嚴(yán)重低估;根據(jù)倫敦大學(xué)Catherine Tuleu 2017年發(fā)表在《藥學(xué)與藥理學(xué)雜志》的論文“Better medicines for children: are we there yet����?”以及美國俄亥俄州辛辛那提大學(xué)Albert Fung等人在2021年底發(fā)表在《難治性罕見病研究》雜志上的論文“Off-label medication use in rare pediatric diseases in the United States”相關(guān)數(shù)據(jù),全球兒童藥物市場規(guī)模呈逐年上升趨勢:2018年全球兒藥市場規(guī)模約為973億美元��,2019年全球兒藥及疫苗市場估值約為1220億美元��,預(yù)計(jì)于2025年達(dá)到1410億美元���。
這種發(fā)展趨勢也推動了全球醫(yī)藥企業(yè)對兒藥的研發(fā)熱情�����;另一方面��,各國政府對兒藥政策不斷推進(jìn)��、對兒藥安全問題的關(guān)注以及對兒童專用藥的重視��,也大大推動了兒藥的發(fā)展���。
美國是兒藥立法監(jiān)管最早的國家����,歐盟則是在加強(qiáng)兒藥管理及政策扶持方面一直努力的組織��,本文就歐美的兒藥相關(guān)法規(guī)及目前全球兒藥項(xiàng)目分布進(jìn)行簡單解讀和梳理���。
歐美政策盤點(diǎn)
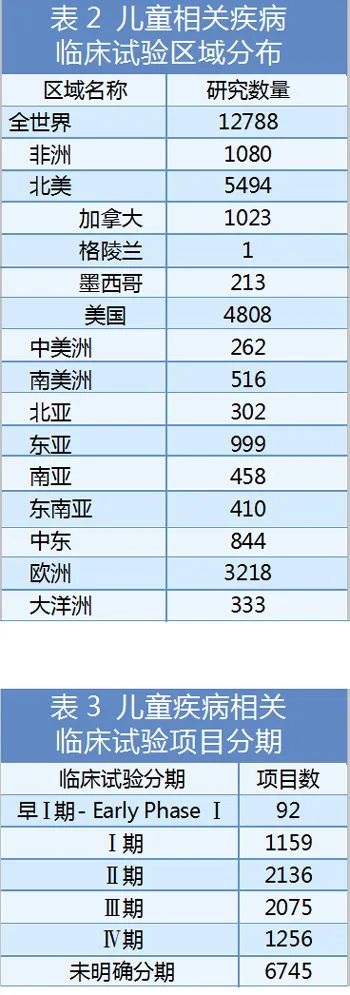
美國是目前全球最大的兒童藥物市場��,也是制藥行業(yè)法規(guī)體系最健全的國家之一��。1979年FDA開始要求藥品標(biāo)簽提供兒童使用信息���,有成套正規(guī)的立法規(guī)定兒藥的研究,積累了相對成熟的政策法規(guī)經(jīng)驗(yàn)��。

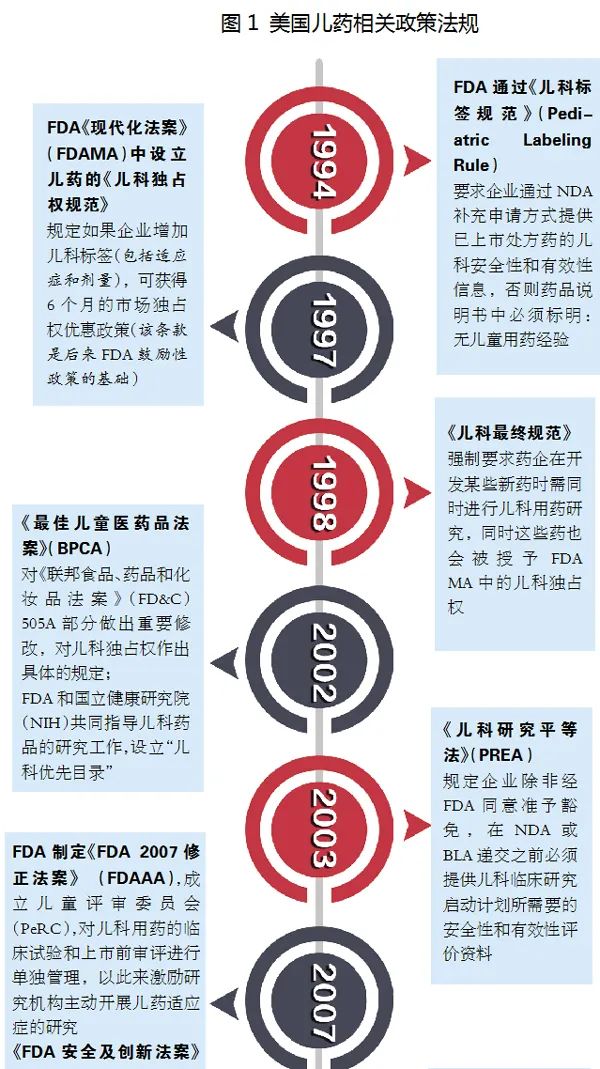
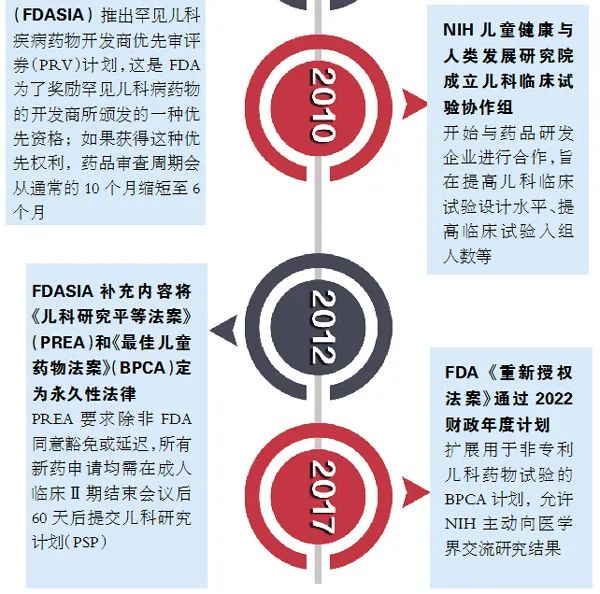
自1997年實(shí)行兒藥《兒科獨(dú)占權(quán)規(guī)范》以來�����,根據(jù)FDA官網(wǎng)披露的數(shù)據(jù)�,截至2020年10月���,共授予兒藥獨(dú)占權(quán)263個(gè)�。其中2019年授予兒藥獨(dú)占權(quán)15個(gè),2020年授予兒科用藥獨(dú)占權(quán)6個(gè)���。且所屬的公司基本都是大型藥企����,小型公司或初創(chuàng)型的公司研發(fā)經(jīng)費(fèi)不足���,一般很難駕馭兒藥開發(fā)所面臨的挑戰(zhàn)和困境���,這也充分體現(xiàn)了兒藥開發(fā)的難度。
歐盟是兒藥的另一個(gè)巨大市場����,其制藥公司的規(guī)模及數(shù)量不容小覷,在加強(qiáng)兒藥管理及政策扶持方面���,歐盟一直在努力�����,1997年��,歐盟委員會在EMA組織的一次專家圓桌會議中討論了兒藥的問題�����,會議認(rèn)為有必要加強(qiáng)立法并引入兒童藥物開發(fā)的激勵機(jī)制�����,這是歐盟兒藥立法的開端��。
這里重點(diǎn)剖析《兒科藥品管理?xiàng)l例》(Paediatric Regulation),該條例要求從2008年7月26日開始�,所有歐洲制藥公司推出的新藥均需通過兒童臨床試驗(yàn),按照兒科調(diào)查計(jì)劃(PIP)的要求就產(chǎn)品的兒童臨床試驗(yàn)進(jìn)行描述��,提供數(shù)據(jù)資料���。
同時(shí)EMA專門成立了一個(gè)兒科委員會(PDCO)����,主要負(fù)責(zé)對PIP的評估��,并負(fù)責(zé)維護(hù)歐洲小兒臨床研究的網(wǎng)絡(luò)�����,制定兒科人群用藥的需求一覽以及其更新��。自2009年1月26日起�,新適應(yīng)癥、新劑型����、新處方的補(bǔ)充申請也必須包括PIP。根據(jù)PIP獲得兒藥數(shù)據(jù)的藥品��,可獲得6個(gè)月的市場保護(hù)期���,其中對于治療罕見疾病的藥品���,該保護(hù)期可延長2年。
另外一方面���,根據(jù)《兒科藥品管理?xiàng)l例》第26條�,對于與藥品的兒科研發(fā)有關(guān)的任何問題�����,EMA均提供免費(fèi)的科學(xué)建議(SA)或協(xié)議協(xié)助(PA)��。這些建議一般由科學(xué)建議工作組(SAWP)提出,并由人用藥品委員會(CHMP)采納通過���。對于兒科用藥研發(fā)的請求���,兒科委員會(PDCO)的成員通常作為專家通過SA程序提供科學(xué)建議。該規(guī)定從2009年至今均有執(zhí)行�。
從EMA及歐盟委員會關(guān)于兒科用藥的行動方案中,我們可以看到其明確的態(tài)度及行動計(jì)劃:確定兒科用藥的需求���、加強(qiáng)決策者的合作�����、確保及時(shí)完成PIP����、改善PIP申請的處置方式��、增加兒科藥物的透明度���。
由此可見����,目前歐盟針對兒科用藥從立法、技術(shù)指南���、管理程序、實(shí)施路徑都已經(jīng)建立了相對完善的體系����。
在研項(xiàng)目分布
盡管各國對兒藥監(jiān)管相關(guān)的政策法規(guī)制定及實(shí)施程度層次不齊,但總體來看在不斷進(jìn)步和完善���,并且對兒藥的開發(fā)持鼓勵和支持的態(tài)度�。在這樣的大環(huán)境下�����,兒藥的開發(fā)勢頭日益迅猛���,種類也更加廣泛�����。
根據(jù)Clinical Trials網(wǎng)站數(shù)據(jù)�����,目前已經(jīng)申報(bào)臨床試驗(yàn)(從尚未招募志愿者到Ⅳ期臨床試驗(yàn))的兒童疾病相關(guān)項(xiàng)目有近13000項(xiàng)(區(qū)域分布見表2)���,所處臨床試驗(yàn)分期見表3���,這些項(xiàng)目涉及的疾病及健康影響原因有約2500多種,其中排在前二十位的疾病種類分布見表4�����。
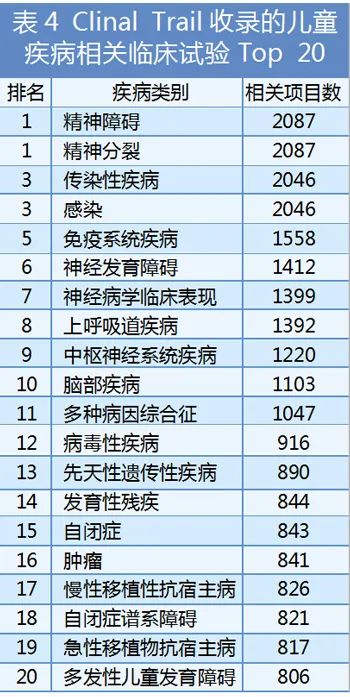
這些數(shù)據(jù)從多方面����、多角度體現(xiàn)了世界范圍內(nèi)兒童藥物的研發(fā)現(xiàn)狀,這種蓬勃發(fā)展的趨勢既是現(xiàn)行相關(guān)政策法規(guī)日趨完善的體現(xiàn)�����,也是督促現(xiàn)行政策法規(guī)不斷完善的一種動力���。
無論是在國外還是國內(nèi)��,要想謀求兒藥研發(fā)及使用的規(guī)范化��,結(jié)合自身特點(diǎn)及優(yōu)勢��,再互相借鑒���、互相學(xué)習(xí)�����,必要時(shí)互相合作才是正途。
相關(guān)
與美國和歐盟相比��,日本未建立法律法規(guī)來強(qiáng)制兒藥開發(fā)�����。為此����,有學(xué)者于2021年利用日本和歐盟之間的兒童適應(yīng)癥批準(zhǔn)滯后的信息,調(diào)查日本兒童藥物開發(fā)的現(xiàn)狀和特點(diǎn)�。
通過對日本2007年1月至2018年12月批準(zhǔn)用于兒科適應(yīng)癥的藥物進(jìn)行研究,發(fā)現(xiàn)在日本和歐盟��,105種兒科適應(yīng)癥藥物的審批滯后中位數(shù)為1017天(日本滯后)����。ATC B類(血液系統(tǒng)用藥)和L類(抗腫瘤及免疫用藥)的滯后情況在2011年后明顯改善�;中位數(shù)不到半年�。通過多區(qū)域臨床試驗(yàn)在全球開發(fā)的藥物與區(qū)域開發(fā)的藥物相比,滯后時(shí)間明顯縮短����。
此外,基于歐洲和日本批準(zhǔn)用于兒科適應(yīng)癥的藥物信息����,有學(xué)者在2020年評估了日本與歐洲兒藥批準(zhǔn)的最新狀況及其特點(diǎn)。他們的研究納入2007-2015年兩地批準(zhǔn)用于兒科適應(yīng)癥的藥物��。采用ATC分類方法計(jì)算兒童適應(yīng)癥藥物的占比��,并對兒童劑型發(fā)展現(xiàn)狀進(jìn)行分析����。確定從成人到兒科適應(yīng)癥批準(zhǔn)的時(shí)間。發(fā)現(xiàn)歐洲共有135種藥物獲批用于兒科適應(yīng)癥��,日本獲批208種�����。
在ATC分類為N(神經(jīng)系統(tǒng)用藥)和J(全身使用抗感染藥)以及隨著兒科劑型的發(fā)展,日本有兒童適應(yīng)癥的藥物在歐洲批準(zhǔn)的兒童適應(yīng)癥藥物中所占比例較其他國家低����。除成人和兒童適應(yīng)證同時(shí)批準(zhǔn)的藥物外,日本成人適應(yīng)癥批準(zhǔn)到兒童適應(yīng)癥批準(zhǔn)最常見的觀察周期為12年以上���,歐洲為3~6年��。這些研究結(jié)果表明���,日本確實(shí)在促進(jìn)兒童用藥的發(fā)展����,但日本從成人適應(yīng)癥到兒科適應(yīng)癥批準(zhǔn)的時(shí)間較歐洲長,某些疾病的兒科藥物發(fā)展緩慢�,有進(jìn)一步改善的空間。
(來源:醫(yī)藥經(jīng)濟(jì)報(bào))