藥品創(chuàng)新賦予醫(yī)藥企業(yè)持之以恒的發(fā)展動力,其需要技術(shù)?人才?資金?政策以及時間的積累,多數(shù)跨國制藥企業(yè)經(jīng)歷了簡單仿制?高端品牌?改良型和自主創(chuàng)新等幾個發(fā)展階段?目前,隨著藥品產(chǎn)業(yè)標準統(tǒng)一和升級?技術(shù)升級?產(chǎn)業(yè)轉(zhuǎn)型?產(chǎn)業(yè)升級和競爭加劇,藥品創(chuàng)新難度越來越大,研發(fā)投入資金占比急劇攀升,中小型醫(yī)藥企業(yè)的發(fā)展壓力與日俱增,全球藥物研發(fā)思路從“群體治療”向“精準治療”轉(zhuǎn)變[1]?改良型新藥在原有藥物基礎上進行改進,具有更好的臨床應用效果,且大部分產(chǎn)品無須進行完整臨床試驗,因此具有較大的市場競爭優(yōu)勢,其優(yōu)越的投入產(chǎn)出比越來越受到廣大醫(yī)藥企業(yè)的重視?在此,通過綜合評估全球和我國改良型新藥的政策與市場競爭發(fā)展態(tài)勢,為我國醫(yī)藥創(chuàng)新發(fā)展提供有益的參考?
全球改良型新藥發(fā)展的基本狀況
1. 1 研發(fā)經(jīng)濟性優(yōu)越

與新化學實體和創(chuàng)新生物藥[2]相比,改良型新藥的研發(fā)時間約短67%,研發(fā)成本約低99%,研發(fā)成功率提高約23%(見表1),尤其在臨床要求上,通過改良其結(jié)構(gòu)?配方及工藝?給藥途徑及適應證,使其有效性?臨床優(yōu)勢?安全性及患者依從性通常更佳,因此具有較大優(yōu)勢[3]?
1. 2 研發(fā)審批數(shù)量較多
以美國為例,修訂后的《聯(lián)邦食品?藥品和化妝品法案》(FD&C Act)505 部分為新藥申請?zhí)峁┝? 條路徑:505(b)(1),即新分子實體藥(創(chuàng)新藥); 505(b)(2),即改良型新藥,包括新適應證,新配方?新劑型?新給藥途徑?新給藥方案等;505(j),即仿制藥?由表2可見, 近10年來,美國食品和藥物管理局(FDA)批準的新藥中505(b)(2)構(gòu)成比超60%,在開發(fā)新靶點越來越難?仿制藥競爭越來越大的情況下,改良型新藥正在成為一個較優(yōu)選擇,逐漸成為研發(fā)主力[4]?

1. 3 臨床優(yōu)勢明顯
改良型新藥是對已上市藥品的升級改良,強調(diào)和注重臨床“優(yōu)效性”,不僅有助于提高藥物臨床效果,減少用藥次數(shù),增強患者的依從性,并且降低了藥物的副作用,提高了安全性[5]?
1. 4 發(fā)展?jié)摿^大
隨著世界經(jīng)濟發(fā)展?人口總量增長?人口老齡化程度提高?人們保健意識增強,以及全球醫(yī)療保障體制的不斷完善,2021 年全球新藥市場銷售額達9 616 億美元,同比增長8. 0%?其中,改良型新藥雖然銷售比重偏小,但隨著其性價比越來越受到青睞,市場發(fā)展?jié)摿σ矊⒃絹碓酱骩6]?
我國改良型新藥發(fā)展的基本狀況
2. 1 政策變化
眾所周知,《藥品注冊管理辦法》是我國藥品注冊管理的重要部門規(guī)章,在規(guī)范藥品注冊行為?引導藥物研發(fā)?促進醫(yī)藥產(chǎn)業(yè)發(fā)展等方面發(fā)揮了重要作用,自2007年起其實施時間跨度已逾10年[7]?2015年,國務院發(fā)布《關(guān)于改革藥品醫(yī)療器械審評審批制度的意見》(國發(fā)〔2015〕44號),深入推進藥品注冊分類改革工作?
2017年,中共中央辦公廳?國務院辦公廳印發(fā)《關(guān)于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》[8],進一步強化藥品注冊分類相關(guān)制度?從2013年提出《藥品注冊管理辦法》修正案小改,到2016年起草《藥品注冊管理辦法(修訂稿)》,調(diào)整為大改,其間經(jīng)歷了多次征求意見,直至2019年12月1日新修訂的《藥品管理法》實施,2020 年7 月1 日新修訂的《藥品注冊管理辦法》實施[9],我國藥品注冊相關(guān)政策得以以法律法規(guī)的形式進一步固化和完善,藥品注冊管理形成相對完善的?以鼓勵藥品創(chuàng)新為主要特點的藥品注冊法規(guī)體系?相較于2007年版藥品注冊分類,新的化學藥?中藥和生物制品注冊分類出現(xiàn)了新變化?對于改良型新藥,主要表現(xiàn)為以下特點[10]?
進一步明確了市場地位:2016年起草的《藥品注冊管理辦法(修訂稿)》征求意見稿中,重新定義了新藥及仿制藥的概念,無論是化學藥品,還是中藥產(chǎn)品和生物制劑產(chǎn)品,均對改良型新藥作出了理念相近的定義歸類,給予其市場地位?
更加突出了臨床優(yōu)勢:新版藥品注冊分類較大的一個特征是,改良型新藥更加注重臨床應用價值(見表3)?

表中2016年征求意見稿和2020年正式稿內(nèi)容基本一致,與2007版相比有較大變化,相應條款不能完全對應,僅供參考)?化學藥2. 1類?2. 2類?2. 3類及生物制品2. 1類均特別強調(diào)“具有明顯臨床優(yōu)勢”?因此,新劑型?新給藥途徑?新復方制劑?新適應證?新工藝成為改良型新藥的主要研發(fā)方向?
重新構(gòu)建了醫(yī)藥企業(yè)轉(zhuǎn)型賽道:相比于全新創(chuàng)新藥的高研發(fā)難度,改良型新藥具有成功率?回報?優(yōu)效性高,風險低,生命周期長等優(yōu)勢,已成為全球新藥研發(fā)的主流?在我國帶量采購和鼓勵藥品創(chuàng)新等政策的影響下,改良型新藥將持續(xù)被市場看好,有利于銷售費用占比較高的制藥公司轉(zhuǎn)型為研發(fā)創(chuàng)新企業(yè)?
2. 2 注冊受理情況
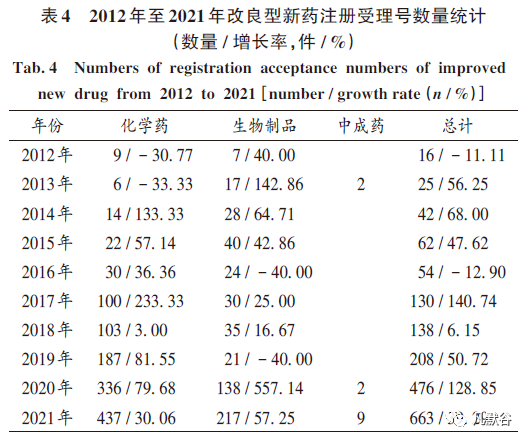
受理號數(shù)量顯著增加:自2016年改良型新藥的定義發(fā)生變化以來,藥品申報注冊受理號數(shù)量開始呈較快速度的增長,2020年新版《藥品注冊管理辦法》出臺?實施前后,改良型新藥注冊受理號數(shù)量更是出現(xiàn)了較大幅度增長(見表4?注冊分類按當年申報時分類定義,按注冊受理號數(shù)量/ 件統(tǒng)計, 表5同),表明隨著藥品注冊政策利好,廣大醫(yī)藥企業(yè)十分看重改良型新藥的研發(fā)注冊工作[11 - 20]?
申請類型以申請臨床為主:從近3 年申請類型來看,無論是化學藥品?治療性生物制品,還是中成藥改良型新藥,申請臨床的注冊受理號數(shù)量均占60%~70%(見表5),表明在新政實施的政策利好形勢下,醫(yī)藥企業(yè)對改良型新藥的研發(fā)熱情持續(xù)高漲?

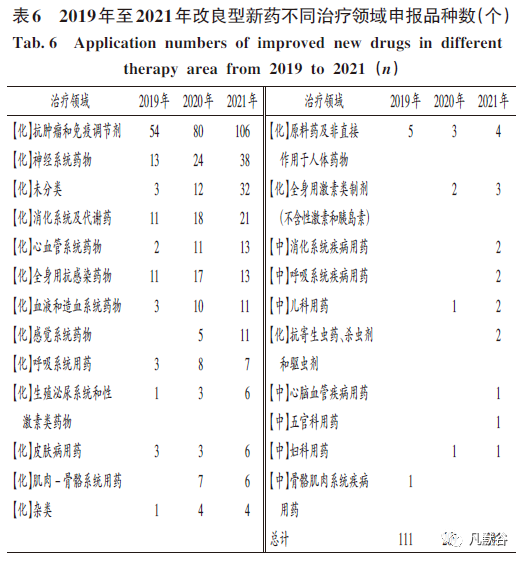
集中于抗腫瘤和免疫調(diào)節(jié)劑治療領(lǐng)域:從近3年注冊申報的品種來看,2019年涉及的品種為111個, 2020年迅速增至209個,同比增長88. 29%;2021年升至292個,同比增長39. 71%(見表6,其中【化】指代學藥類,【中】指中藥類?注冊分類按當年申報時分類定義,按注冊品種數(shù)量統(tǒng)計,表7同)?從2021年排名領(lǐng)先的品種治療領(lǐng)域來看,其與我國疾病譜的類型與變化相適應,符合當前改良型新藥的主要研發(fā)方向?
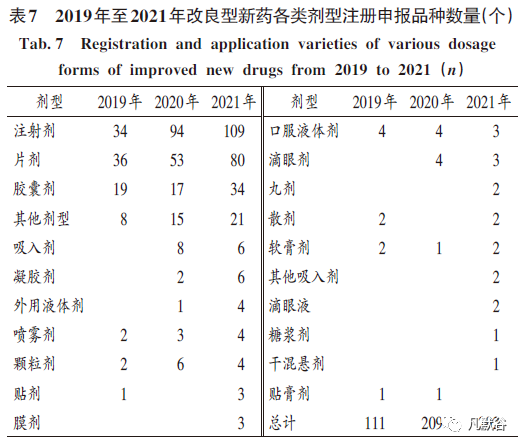
以注射劑型為主:從近3年注冊申報的品種來看,常規(guī)劑型為主要劑型,且以注射劑?片劑?膠囊劑為主?而以新劑型為主的一些劑型如吸入劑?凝膠劑?噴霧劑?貼劑?膜劑等品種數(shù)量較少,表明對新劑型的開發(fā)力度和熱度相對較低(見表7)?

2022年5月9日國家藥品監(jiān)督管理局發(fā)布的《中華人民共和國藥品管理法實施條例(修訂草案征求意見稿)》第28條表明,國家鼓勵兒童用藥品的研制和創(chuàng)新,支持藥品上市許可持有人開發(fā)符合兒童生理特征的兒童用藥品新品種?新劑型?新規(guī)格,對兒童用藥品予以優(yōu)先審評審批,并引入市場獨占期政策?這為改良型新藥研發(fā)中側(cè)重兒童用藥品新劑型的開發(fā)提供了更強的動力?
2. 3 市場應用情況
近年來,隨著國家藥品注冊制度的改革與優(yōu)化政策引導,我國改良型新藥市場發(fā)展勢頭強勁,具有較大的臨床應用和市場發(fā)展?jié)摿?并呈現(xiàn)以下特點?
“國內(nèi)國外雙驅(qū)并舉”的競爭格局凸顯:當前在我國改良型新藥的注冊審批申報環(huán)節(jié)中,集中分布了外資與國企兩大企業(yè)群體且企業(yè)相對集中,其中外資企業(yè)包括羅氏制藥?諾華制藥?拜耳制藥?強生制藥?武田制藥等,國企主要有恒瑞醫(yī)藥?正大天晴藥業(yè)?齊魯制藥?江蘇豪森制藥等傳統(tǒng)企業(yè),以及百奧泰生物科技制藥?上海復宏漢霖制藥?信達生物制藥等創(chuàng)新型企業(yè)?兩大陣營的改良型新藥研發(fā)已形成“雙驅(qū)并舉”的競爭局面?
上市品種銷售呈快速增長勢頭:從2016年至2018年申請改良型新藥注冊并批準的部分產(chǎn)品的上市銷售狀況來看,其在醫(yī)院市場的銷售金額均呈快速增長趨勢,部分增加適應證的產(chǎn)品在經(jīng)歷低增長期后又重現(xiàn)高增長態(tài)勢;部分品種由于仿制產(chǎn)品的進入則顯得增長乏力?
醫(yī)保保障產(chǎn)品銷售快速增長:同時也發(fā)現(xiàn),從2016年至2018年申請改良型新藥注冊并批準的部分產(chǎn)品基本納入了醫(yī)保報銷范疇,從而實現(xiàn)產(chǎn)品銷售額的快速增長(見表8)?個別品種如糠酸氟替卡松維蘭特羅粉吸入劑(Ⅱ)由于未進入醫(yī)保,銷售情況欠佳?
我國改良型創(chuàng)新型新藥的發(fā)展政策建議
當前,我國正處于從仿制藥時代向科技創(chuàng)新含量更高的改良型新藥?創(chuàng)新藥轉(zhuǎn)型的過渡期?在臨床需求刺激改良型新藥的開發(fā)應用,政策支持提高行業(yè)改良型新藥的研發(fā)熱情,新技術(shù)應用能更好地滿足市場的差異化競爭需求三大因素促進下,我國改良型新藥作為創(chuàng)新藥的一個重要組成部分,市場發(fā)展前景良好,但同時也存在諸多影響因素制約改良型新藥行業(yè)的市場發(fā)展速度和潛力?因此,我國改良型新藥市場發(fā)展還需在“三醫(yī)聯(lián)動”機制下,通過加大國家產(chǎn)業(yè)政策扶持?藥品審評審批機制引導?醫(yī)保支付支持及醫(yī)療臨床使用優(yōu)先等措施,進一步激發(fā)和調(diào)動醫(yī)藥企業(yè)的研發(fā)熱情?主要建議如下?
產(chǎn)業(yè)扶持政策方面: 在國家創(chuàng)新機制方面出臺相關(guān)鼓勵和扶持政策[21],通過各地發(fā)展改革部門?工信部門?科技部門出臺針對改良型新藥的鼓勵扶持措施,鼓勵科技立項,激發(fā)研發(fā)熱情,引導企業(yè)轉(zhuǎn)型,營造創(chuàng)新氛圍;鼓勵和激勵傾向于改良型新藥“產(chǎn)?學?研?轉(zhuǎn)?用”的研究與創(chuàng)新新模式,給予更強的藥品知識產(chǎn)權(quán)保護力度,從而提高藥品自主創(chuàng)新能力;建立多種形式的產(chǎn)業(yè)投融資和信貸渠道,如產(chǎn)業(yè)扶持基金?投資公司?私募基金等,以助力改良型新藥的研發(fā)進程?
藥監(jiān)審評審批政策方面:進一步優(yōu)化改良型新藥的相關(guān)審評審批制度,優(yōu)先納入審評審批程序,出臺針對性的指南建議,有利于改良型新藥研發(fā)工作的開展[7];針對臨床需要和市場需要的品類,如兒童用藥的改良型新藥的研發(fā),進一步優(yōu)化臨床試驗的相關(guān)政策,加快醫(yī)藥企業(yè)對兒童用藥的研發(fā)進度;進一步優(yōu)化中藥改良型新藥開發(fā)中針對中成藥上市后二次開發(fā)中改工藝?增加適應證等方面的措施[22],鼓勵藥品上市許可持有人對已上市中藥深入開展研究,優(yōu)化生產(chǎn)工藝等,提高臨床效果,進一步提升已上市中藥的質(zhì)量;增加改良型新藥的市場獨占保護期[23],進一步落實《中華人民共和國藥品管理法實施條例(修訂草案征求意見稿)》第二十八條中針對兒童用藥改良型的研發(fā)給予市場獨占期的利好條款?
醫(yī)保支付政策方面:將改良型新藥及時納入醫(yī)保目錄,保證患者能在最短時間內(nèi)得到治療,確保臨床可及性;進一步優(yōu)化改良型新藥定價機制,給予醫(yī)藥企業(yè)一定的價格期限保護,促進醫(yī)藥企業(yè)在研發(fā)?轉(zhuǎn)化?收益?再研發(fā)的軌道上良性循環(huán)?針對一些臨床急需且為新劑型?新給藥途徑的改良型新藥,在集中采購制度環(huán)節(jié)與其他產(chǎn)品能夠有所區(qū)分,鼓勵單獨招標?
醫(yī)療臨床使用政策政策方面:將改良型新藥優(yōu)先納入臨床用藥指南,優(yōu)先臨床處方應用,提高其處方率,更多地惠及患者;完善改良型新藥的臨床試驗政策,鼓勵臨床醫(yī)師參與其中?
參考文獻:詳見《中國藥業(yè)》2022年9月20日第31卷第18����。
(來源:醫(yī)前沿)